
【题目】工业合成氨反应:N2+3H2![]() 2NH3是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H-H键、1 mol N-H键、1 mol N≡N键放出能量分别为436 kJ、391 kJ、946 kJ。则:
2NH3是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H-H键、1 mol N-H键、1 mol N≡N键放出能量分别为436 kJ、391 kJ、946 kJ。则:
(1)若1 mol N2完全反应生成NH3可________(填“吸收”或“放出”)热量________kJ。
(2)如果将1 mol N2和3 mol H2混合,使其充分反应,放出的热量总小于上述数值,其原因是________________________。
(3)实验室模拟工业合成氨时,在容积为2 L的密闭容器内,反应经过10 min后,生成10 mol NH3,则用N2表示的化学反应速率为________mol·L-1·min-1。
(4)一定条件下,当合成氨的反应达到化学平衡时,下列说法正确的是________。
a.正反应速率和逆反应速率相等
b.正反应速率最大,逆反应速率为0
c.N2的转化率达到最大值
d.N2和H2的浓度相等
e.N2、H2和NH3的体积分数相等
f.反应达到最大限度
【答案】放出92该反应是可逆反应,1 mol N2和3 mol H2不能完全反应,因此放出能量总是小于92 kJ0.25acf
【解析】
(1)反应热等于断键吸收的能量和形成化学键所放出的能量的差值,则反应的N2+3H2![]() 2NH3的ΔH=(946+436×3-391×6)kJ/mol=-92kJ/mol,所以若1mol N2完全反应生成NH3可放出热量92kJ。
2NH3的ΔH=(946+436×3-391×6)kJ/mol=-92kJ/mol,所以若1mol N2完全反应生成NH3可放出热量92kJ。
(2)由于该反应是可逆反应,1 mol N2和3 mol H2不能完全反应生成2mol氨气,因此放出能量总是小于92 kJ。
(3)在容积为2L的密闭容器中进行,反应经过10min后,生成10mol NH3,则消耗氮气5mol,浓度是2.5mol/L,用N2表示的化学反应速率是2.5mol/L÷10min=0.25 mol·L -1·min-1。
(4)a.达到化学平衡时,正反应速率和逆反应速率一定相等,a正确;
b.达到化学平衡时,正反应速率和逆反应速率一定相等,且均不为0,b错误;
c.达到化学平衡时,即达到反应最大限度,N2的转化率达到最大值,c正确;
d.达到化学平衡时,N2和H2的浓度不再改变,但不一定相等,d错误;
e.达到化学平衡时,N2、H2和NH3的体积分数不变,但不一定相等,e错误;
f.达到化学平衡时,反应达到最大限度,f正确。
答案选acf。


 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)烷烃A在同温、同压下蒸气的密度是H2的36倍,其分子式为___。
(2)写出天然橡胶单体(2—甲基—1,3—丁二烯)的结构简式___。
(3)立方烷![]() 的一氯代物有___种,它的六氯代物有___种。
的一氯代物有___种,它的六氯代物有___种。
(4)下列物质的沸点按由高到低的顺序排列正确的是___。
①CH3(CH2)2CH3②CH3(CH2)3CH3③(CH3)3CH④(CH3)2CHCH2CH3
A.②④①③ B.④②①③ C.④③②① D.②④③①
(5)下列选项中互为同系物的是____;互为同分异构体的是____;属于同种物质的是___。
①H2O和D2O②1H、2H、3H③乙烯和环丙烷(C3H6)④![]() 与
与![]() ⑤
⑤![]() 与
与![]() ⑥戊烯和环戊烷⑦
⑥戊烯和环戊烷⑦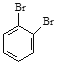 和
和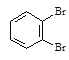
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学中几种常见物质的转化关系如图所示(部分生成物已略去)。其中,A为黑色固体;C、D为金属单质,且D为红色;H为红棕色粉末,常用作红色油漆和涂料。
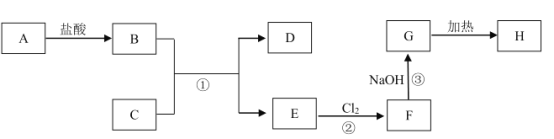
(1)写出物质H的化学式:___。
(2)写出下列反应的离子方程式:反应②___,反应③___。
(3)向E溶液中滴入NaOH溶液时,生成的白色絮状沉淀迅速变成灰绿色,最后变成红褐色。写出沉淀由白色变成红褐色的化学方程式:___。
(4)印刷电路板是由高分子材料和金属D复合而成的。刻制印刷电路时,要用过量的F溶液作为“腐蚀液”,其在刻制过程中作___(填“氧化”或“还原”)剂,写出该反应的离子方程式:___。
(5)某同学通过实验实现了反应F→E的转化,为了检验F是否完全转化为E,设计如下实验方案:取少量F于试管中,加水溶解,并滴加KSCN溶液,再向其中加入粉末C,振荡。当观察到___现象时,证明F完全转化为E。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,向10 mL 0.01 mol·L-1 NaCN溶液中逐滴加入0.01 mol·L-1的盐酸,其pH变化曲线如下图甲所示。NaCN溶液中CN-、HCN浓度所占分数(δ)随pH变化的关系如下图乙所示[其中a点的坐标为(9.5,0.5)]。
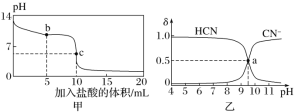
下列溶液中的关系一定正确的是( )
A.图乙中pH=7的溶液:c(Cl-)=c(HCN)
B.常温下,NaCN的水解平衡常数:Kh(NaCN)=10-9.5
C.图甲中b点的溶液:c(CN-)>c(Cl-)>c(HCN)>c(OH-)>c(H+)
D.图甲中c点的溶液:c(Na+)+c(H+)=c(HCN)+c(OH-)+c(CN-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境保护是目前人类面临的一项重大课题。为应对燃料使用造成的环境污染,科学家提出了利用太阳能促进燃料循环使用的构想,其构想可用下图表示:
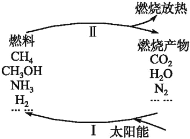
其中过程Ⅰ的主要反应为①2CO2![]() 2CO+O2,②2H2O
2CO+O2,②2H2O![]() 2H2↑+O2↑,③2N2+6H2O
2H2↑+O2↑,③2N2+6H2O![]() 4NH3+3O2,④2CO2+4H2O
4NH3+3O2,④2CO2+4H2O![]() 2CH3OH+3O2,⑤CO2+2H2O
2CH3OH+3O2,⑤CO2+2H2O![]() CH4+2O2。
CH4+2O2。
下列说法中不正确的是
A.过程Ⅱ中发生的反应均为放热反应
B.太阳能最终主要转化为热能
C.经过上述一个循环后放出O2
D.要实现上述循环,当前需要解决的关键问题是过程Ⅰ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物、二氧化硫是造成大气污染的主要物质,某科研小组进行如下研究。
(1)已知:
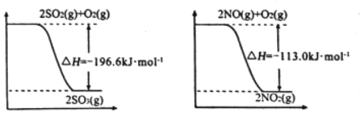
写出SO2(g)与NO2(g)反应生成SO3(g)和NO(g)的热化学方程式:________________;
(2)向容积为1 L的密闭容器中分别充入0.1 mol NO2和0.15 mol SO2,在不同温度下测定同一时刻NO2的转化率,结果如图所示:
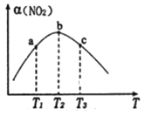
①a、c两点反应速率大小关系:v(a)____v(c)(填“>”“<”或“=”)。若在某温度下达平衡,保持温度、容器的容积不变,再向容器中充入0.2 mol NO2(g)和0.3 mol SO2,NO2的转化率___________(填“增大”“减小”或“不变”);
②在温度小于T2时,NO2的转化率随温度升高而增大的原因是_________;
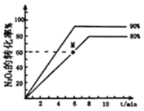
(3)己知可逆反应,N2O4(g)![]() 2NO2(g),v正=k正c(N2O4),v逆=k逆c2(NO2) (k正、k逆只是温度的函数)。向1 L体积固定的密闭容器中充入1 mol N2O4气体分别在T1、T2 (T1>T2)温度下进行该反应。N2O4的转化率与温度、时间的关系如图所示,T1时,该反应的△H____________0(填“>”“<”或“=”),计算M点v正:v逆=_________ (保留到小数点后1位)。
2NO2(g),v正=k正c(N2O4),v逆=k逆c2(NO2) (k正、k逆只是温度的函数)。向1 L体积固定的密闭容器中充入1 mol N2O4气体分别在T1、T2 (T1>T2)温度下进行该反应。N2O4的转化率与温度、时间的关系如图所示,T1时,该反应的△H____________0(填“>”“<”或“=”),计算M点v正:v逆=_________ (保留到小数点后1位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人造海绵的主要成分是聚氨酯,合成方法如下:
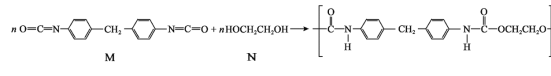
下列说法正确的是( )
A.M 属于芳香烃B.N 与乙醇互为同系物
C.合成聚氨酯的反应属于缩聚反应D.聚氨酯在一定条件下可发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组研究 FeCl3 溶液与 Na2SO3 溶液之间的反应,进行如下实验探究
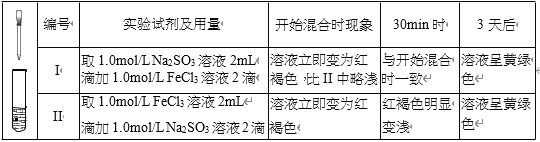
(1)配制 FeCl3 溶液时,先将 FeCl3 溶于浓盐酸,再稀释至指定浓度。结合化学用语说 明浓盐酸的作用:______。
(2)甲同学认为,上述实验在开始混合时观察到的现象不涉及氧化还原反应,实验 I中红褐色比 II 中略浅的原因是______。
(3)乙同学认为实验 II 可能发生了氧化还原反应,为了探究反应的产物做了实验 III和生成物检验。

① 取少量 Na2SO3 溶液电极附近的混合液,加入______,产生白色沉淀,证明产生了 SO42-。
② 该同学又设计实验探究另一电极的产物,取少量FeCl3溶液电极附近的混合液,加入铁氰化钾溶液,产生____________________,证明产生了Fe2+。
(4)实验 III 发生反应的方程式是______。
(5)实验小组查阅资料:溶液中 Fe3+、 SO32-、OH-三种微粒会形成红色配合物并存在如下转化:
![]()
从反应速率和化学平衡两个角度解释实验 I、II 现象背后的原因可能是:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国发射宇宙飞船的 “神舟”系列火箭用偏二甲肼(C2H8N2)作燃料,液态四氧化二氮作氧化剂,生成氮气和二氧化碳气体。
(1)写出反应的化学方程式: _______________________________。
(2)该反应是________(填“放热”或“吸热”)反应,反应物的总能量________(填“大于”、“小于”或“等于”)生成物的总能量,断开化学键________的总能量________(填“大于”、“小于”或“等于”)形成化学键________的总能量。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com