
分析 铁粉和氧化铁的混合物中加入稀硫酸,恰好完全反应,放出氢气,反应后的溶液中滴加KSCN不显红色,且无固体剩余物,则最终溶液中溶质为FeSO4,发生反应:Fe+Fe2O3+3H2SO4=3FeSO4+3H2O、Fe+H2SO4=FeSO4+H2↑,计算生成2.24L氢气时消耗Fe、H2SO4的物质的量,设原混合物中Fe2O3的物质的量为xmol,根据化学方程式表示出与氧化铁反应消耗Fe、H2SO4的物质的量,再根据混合物总质量列方程计算.
(1)发生反应方程式为:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O、Fe2(SO4)3+Fe=3FeSO4,Fe+H2SO4=FeSO4+H2↑,由此书写离子方程式;
(2)根据m=nM计算混合物氧化铁和铁的质量,再根据n=$\frac{m}{M}$计算出铁的物质的量;根据n=$\frac{n}{V}$计算硫酸的物质的量浓度.
解答 解:(1)发生反应方程式为:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O、Fe2(SO4)3+Fe=3FeSO4,Fe+H2SO4=FeSO4+H2↑,离子方程式分别为:Fe2O3+6H+=2Fe3++3H2O、2Fe3++Fe=3Fe2+,Fe+2H+=Fe2++H2↑,故答案为:Fe2O3+6H+=2Fe3++3H2O、2Fe3++Fe=3Fe2+、Fe+2H+=Fe2++H2↑;
(2)铁粉和氧化铁的混合物中加入稀硫酸,恰好完全反应,放出氢气,反应后的溶液中滴加KSCN不显红色,且无固体剩余物,则最终溶液中溶质为FeSO4,
反应生成 H2的物质的量为:$\frac{2.24L}{22.4L/mol}$=0.1mol,则:
Fe+H2 SO4=FeSO4+H2↑
0.1mol 0.1mol 0.1mol
设原混合物中Fe2O3的物质的量为xmol,则:
Fe+Fe2O3+3H2SO4=3FeSO4+3H2O
x mol x mol 3x mol
由题意可知:(x+0.1)mol×56g/mol+x mol×160g/mol=27.2g,
解得x=0.1mol,
混合物中m(Fe2O3)=0.1 mol×160 g•mol-1=16g,m(Fe)=27.2g-16g=11.2g,则铁的物质的量为:$\frac{11.2g}{56g/mol}$=0.2mol,
n(H2SO4)=(3x+0.1)mol=(3×0.1+0.1)mol=0.4mol,则c(H2SO4)=$\frac{0.4mol}{0.1L}$=4mol/L
故答案为:0.2;0.1;4.
点评 本题考查混合物反应的计算,题目难度中等,明确发生反应的实质为解题关键,注意根据方程式解答,侧重考查学生的分析能力及化学计算能力.


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案科目:高中化学 来源: 题型:解答题
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 2 mol HI | 1mol H2+1mol I2 | 2mol HI+1mol H2+1mol I2 |
| HI的浓度 | c1 | c2 | c3 |
| 反应的能量变化 | 吸收akJ | 放出bkJ | 吸收ckJ |
| 体系压强(Pa) | p1 | p2 | p3 |
| 反应物转化率 | a1 | a2 | a3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 75.77%表示35Cl的质量分数 | |
| B. | 35.5表示氯元素的近似相对原子质量 | |
| C. | 24.23%表示35Cl的丰度 | |
| D. | 36.966表示37Cl的质量数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验编号 | XOH物质的量浓度(mol•L-1) | 盐酸物质的量浓度(mol•L-1) | 混合溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | b | 0.2 | pH=7 |
| 丙 | 0.2 | 0.1 | pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
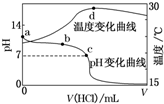 室温下,将1.000mol•L-1盐酸滴入20.00mL1.000mol•L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )
室温下,将1.000mol•L-1盐酸滴入20.00mL1.000mol•L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )| A. | a点由水电离出的c(H+)=1.0×10-14 mol•L-1 | |
| B. | b点:c(NH${\;}_{4}^{+}$)+c(NH3•H2O)=c(Cl-) | |
| C. | c点:c(Cl-)=c(NH${\;}_{4}^{+}$) | |
| D. | d点后,溶液温度略下降的主要原因是NH3•H2O电离吸热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向FeCl3饱和溶液中滴加NaOH溶液形成红褐色的分散系 | |
| B. | 一支钢笔使用两种不同牌子的蓝黑墨水,易出现堵塞 | |
| C. | 在河水与海水的交界处,易有三角洲形成 | |
| D. | 水泥厂、冶金厂常用高压电除去烟尘,是因为烟尘微粒带电荷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 溶液 | 是否产生沉淀 | 沉淀成分 |
| ① | Ca(OH)2 | ||
| ② | BaCl2 | ||
| ③ | BaCl2和氨水 | ||
| ④ | BaCl2和氯水 | ||
| ⑤ | H2S | ||
| ⑥ | Ba(NO3) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com