
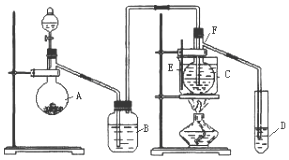
分析 装置A:为乙炔发生器,碳化钙与食盐水反应制备乙炔,该反应为CaC2+2H2O=Ca(OH)2+C2H2↑,B为洗气瓶,除去由A装置导出的气流中混有的H2S,F为主反应器;D为吸收器.
(1)根据H2S的性质选择除杂溶液,H2S具有酸性,能与碱液反应,如不除去,会导致催化剂中毒;
(2)生成的乙醛能溶于水,D应是气体吸收装置;
(3)加入药品时应先加固体药品,浓硫酸和水加入时要注意防止液体飞溅;
(4)水的沸点是100℃,用水浴加热,加热温度不可能超过100℃,水浴加热的温度是使反应容器内试剂受热温度均匀,由反应所需的温度(75℃),确定加热的温度和加热方法;
(5)根据乙醛的性质选择检验方法.
解答 解:(1)实验开始时,仪器A中盛放电石,碳化钙与食盐水反应制备乙炔,乙炔中混有杂质硫化氢,如不除去,会导致催化剂中毒,B中装NaOH溶液,其作用是利用H2S具有酸性,能与碱液反应除去,
故答案为:除去混合气体中H2S等气体,避免催化剂中毒;
(2)本实验目的是制备乙醛,乙醛易溶于水,仪器D中盛放水,可用蒸馏水收集,
故答案为:吸收生成的乙醛蒸气;
(3)加入药品时应先加固体药品,浓硫酸和水加入时要注意防止液体飞溅,应将密度大的加入到密度小的液体中,加入固体药品时要用纸槽或药匙,防止固体药品打破仪器,所以加入的先后顺序为:氧化汞→水→浓H2SO4,
故答案为:氧化汞→水→浓H2SO4;
(4)由反应所需的温度(75℃),可以选择水浴加热方式同时选择量程为0~100℃的温度计较适宜,
故答案为:水浴加热;B;
(5)乙醛的检验,一般是利用了醛类物质的通性--跟新制的Cu(OH)2反应生成砖红色沉淀,即取D中溶液少量,加入新制Cu(OH)2悬浊液,加热,若产生砖红色沉淀即可证明乙醛已制得,
故答案为:取D中溶液少量,加入新制Cu(OH)2悬浊液,加热,若产生砖红色沉淀即可证明乙醛已制得.
点评 本题是一道关于物质的制备和检验以及固、液药品的加入顺序,加热的方法和温度计的使用等基本操作内容的综合性实验题,注意气体制备的一般方法和注意事项,题目难度中等.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 →
→
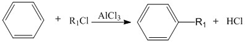
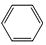 +R1Cl$\stackrel{AlCl_{3}}{→}$
+R1Cl$\stackrel{AlCl_{3}}{→}$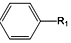 +HCl
+HCl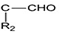 +H2O(R1、R2、R3代表烃基或氢原子)回答下列问题:
+H2O(R1、R2、R3代表烃基或氢原子)回答下列问题: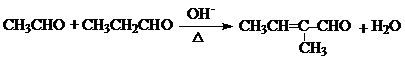 .
.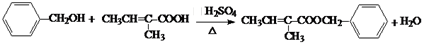 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙苯是一种用途广泛的有机原料,可制备多种化工产品.
乙苯是一种用途广泛的有机原料,可制备多种化工产品. +Cl2(g)$\stackrel{催化剂}{?}$
+Cl2(g)$\stackrel{催化剂}{?}$ -CH(g)+HCl(g)△H>0,T℃时,向一恒压密闭容器中充入等物质的量的乙苯气体和氯气发生上述反应(已排除其他反应干扰),测得乙苯物质的量分数随时间变化如表所示:
-CH(g)+HCl(g)△H>0,T℃时,向一恒压密闭容器中充入等物质的量的乙苯气体和氯气发生上述反应(已排除其他反应干扰),测得乙苯物质的量分数随时间变化如表所示:| 时间/(min) | 0 | 2 | 5 | 6 | 9 | 10 |
| χ(乙苯) | 0.5 | 0.25 | 0.1 | 0.1 | 0.05 | 0.05 |
 $\stackrel{催化剂}{?}$
$\stackrel{催化剂}{?}$ =CH2(g)+H2(g)△H=+124kJ/mol
=CH2(g)+H2(g)△H=+124kJ/mol查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 硅酸盐一般不溶于水,它是水泥、陶瓷、玻璃的主要成分 | |
| B. | SiO2与CO2相似,由一个硅原子和两个氧原子构成一个SiO2分子 | |
| C. | SiO2是酸性氧化物,能与水反应生成硅酸 | |
| D. | 硅元素是构成矿物岩石的主要成分之一,其化合态几乎全部是氧化物和硅酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
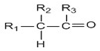
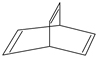 有机物的结构可用键线式简化表示,如CH3-CH═CH-CH3可表示为
有机物的结构可用键线式简化表示,如CH3-CH═CH-CH3可表示为 有一种有机物X的键线式如图所示.
有一种有机物X的键线式如图所示. .
.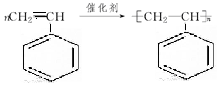 .
.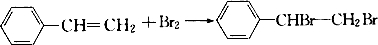 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C 的生成速率与 C 的分解速率相等 | |
| B. | 单位时间内消耗 amolA,同时生成 3amolC | |
| C. | 容器内压强不再变化 | |
| D. | 混合气体的物质的量不再变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com