
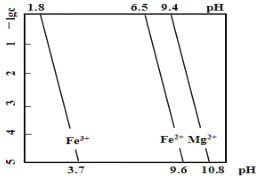
【题目】某工业废渣的主要成分为 SiO2、FeO、MgO,对其进行处理以回收废渣中的金属元素。25℃时,金属离子的物质的量浓度的负对数(-lg c)与溶液pH的关系如图所示(一般离子浓度 c≤10-5mol/L时,即认为该离子在溶液中不存在)。下列有关说法不正确的是
A.分离废渣中的SiO2,可以用过量的盐酸充分反应后过滤
B.可以用氯水将Fe2+氧化成Fe3+以便于铁元素与镁元素的分离
C.沉淀金属元素的顺序是先沉淀镁元素再沉淀铁元素
D.用 NaOH 调节pH沉淀铁元素时,pH应控制略大于3.7
【答案】C
【解析】
A.回收废渣中的金属元素,可加盐酸分离出SiO2;
B.结合图中pH可知,铁离子在pH为3.7附近沉淀完全;
C.先沉淀铁离子,过滤后再沉淀镁子,可分离;
D.铁离子在pH为3.7附近沉淀完全,此时镁以离子存在。
A.回收废渣中的金属元素,SiO2与盐酸不反应,MgO、FeO均溶于盐酸,则分离废渣中的 SiO2,可以用过量的盐酸充分反应后过滤,A正确;
B.结合图中pH可知,Fe3+在pH为3.7附近沉淀完全,则用氯水将 Fe2+氧化成 Fe3+以便于铁元素与镁元素的分离,B正确;
C.Fe3+、Mg2+形成沉淀需要溶液的pH:Fe3+<Mg2+,所以先沉淀Fe3+形成Fe(OH)3沉淀,过滤后再沉淀Mg2+,使Mg2+形成Mg(OH)2沉淀,而可分离,离子沉淀的顺序不合理,C错误;
D.Fe3+在pH为3.7附近沉淀完全,此时镁以Mg2+存在于溶液中在,则用NaOH调节pH沉淀铁元素时,pH应控制略大于3.7,D正确;
故合理选项是C。


 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案科目:高中化学 来源: 题型:
【题目】下图是制备乙酸乙酯的两种装置,下列说法错误的是

A.相比于 b,a装置具有副反应少、原料利用率高等优点
B.加入的浓硫酸要稍多于催化剂用量的原因是浓硫酸还起到吸水剂的作用,推动平衡正向进行
C.反应结束后,将收集到的产品倒入分液漏斗中,振荡、放气、静置、分液,然后从下口放出制备的产物
D.乙酸乙酯在饱和碳酸钠溶液中的溶解度较小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图所示。下列说法不正确的是( )
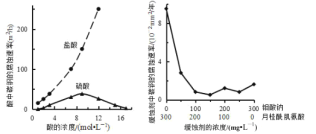
A.盐酸的浓度越大,腐蚀速率越快
B.钼酸钠和月桂酰肌氨酸的浓度相等时,腐蚀速率最小
C.碳素钢的腐蚀速率不随硫酸的浓度增大而增大,说明反应速率不与c(H+)成正比
D.对比盐酸和硫酸两条曲线,可知 Cl-也会影响碳素钢的腐蚀速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对分子性质的解释中,不正确的是
A. 水很稳定(1000℃以上才会部分分解)是因为水中含有大量的氢键
B. 乳酸有一对对映异构体,因为其分子中含有一个手性碳原子
C. 碘易溶于四氯化碳,甲烷难溶于水都可用“相似相溶”解释
D. 由右图可知酸性:H3PO4>HClO,因为H3PO4的非羟基氧原子数大于次氯酸的非羟基氧原子数 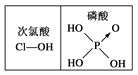
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】北京奥运会主体育场——“鸟巢”,被《泰晤士报》评为全球“最强悍”工程,“鸟巢”运用了高强度、高性能的钒氮合金高新钢和884块ETFE膜,并采用新一代的氮化镓铟高亮度LED材料,有关说法正确的是
A.ETFE膜![]() 是由两种单体缩聚而成的
是由两种单体缩聚而成的
B.已知Ga处于ⅢA族,可推知氮化镓化学式为Ga3N2
C.合金的熔点通常比组分金属高,硬度比组分金属小
D.用金属铝与V2O5冶炼钒,铝作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浅绿色盐X仅含四种元素,不含结晶水,M(X)<908gmol-1,某小组为了探究X的组成和性质,设计并完成了如下实验

上述实验中,得到23.3g白色沉淀 E、28.8g红色固体G和12.8g红色固体H。
已知:①X分解成A、B、C的反应为非氧化还原反应;
②常温下B呈液态且1个B分子含有10个电子。
请回答如下问题:
(1)写出B分子的电子式_______________;X的化学式是__________。
(2)在隔绝空气、570℃温度下加热X至完全分解的化学反应方程式为:__________。
(3)请写出G溶于D溶液的离子方程式:_________________。
(4)请设计实验检验固体C中是否仍含有X:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种水基二次电池原理如下式,电解液为含Zn2+的水溶液,该电池可用于电网贮能。xZn+Zn0.25V2O5﹒yH2O![]() Zn0.25V2O5﹒zH2O+(y-z)H2O。下列说法正确的是
Zn0.25V2O5﹒zH2O+(y-z)H2O。下列说法正确的是
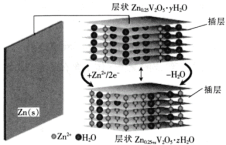
A.放电时,Zn2+脱离插层
B.放电时,溶液中Zn2+浓度一直减小
C.充电时,电子由![]() 层经电解质溶液流向
层经电解质溶液流向![]() 层
层
D.充电时,阳极反应为:Zn0.25V2O5﹒zH2O+(y-z)H2O-2xe-= Zn0.25V2O5﹒yH2O+xZn2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有K+、Fe2+、Ca2+、![]() 、
、![]() 、Cl-、I-中的几种离子。根据下方实验操作与现象,推测合理的是
、Cl-、I-中的几种离子。根据下方实验操作与现象,推测合理的是
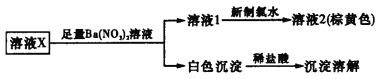
A.取溶液2,加入AgNO3溶液,可确定溶液X中是否含有Cl-
B.溶液X中一定不含Fe2+、Ca2+、![]()
C.溶液X中是否存在K+还需要通过焰色反应进一步确认
D.溶液X的溶质为K2CO3和KI
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com