
【题目】下列装置由甲、乙部分组成(如图所示),甲是将废水中乙二胺[H2N(CH2)2NH2]氧化为环境友好物质形成的化学电源。当电池工作时,下列说法正确的是

A. 电子的流动方向M→Fe→CuSO4溶液→Cu-N
B. M极电极反应式: H2N(CH2)2NH2+16OH--16e-==2CO2↑+N2↑+12H2O
C. 当N极消耗5.6LO2时,则铁极增重32g
D. 一段时间后,乙中CuSO4溶液浓度基本保持不变
【答案】D
【解析】根据题给信息知,甲图中装置是将化学能转化为电能的原电池,M是负极,N是正极,电解质溶液为酸性溶液,负极上失电子发生氧化反应,正极上得电子发生还原反应;乙部分是在铁上镀铜,则铁为阴极应与负极相连,铜为阳极应与正极相连。A.M是负极,N是正极,电子不能通过溶液,故A正确;B.H2N(CH2)2NH2在负极M上失电子发生氧化反应,生成但其、二氧化碳和水,电极反应式为H2N(CH2)2NH2+4H2O-16e-═2CO2↑+N2↑+16H+,故B错误;C.未注明是否为标准状况,无法计算5.6LO2的物质的量,故C错误;D.乙部分是在铁上镀铜,电解液浓度基本不变,所以乙中CuSO4溶液浓度基本保持不变,故D正确;故选D。


科目:高中化学 来源: 题型:
【题目】活性氧化锌(ZnO)粒径介于1-100 nm之间,是一种面向21世纪的新型高功能精细无机产品,表现出许多特殊的性质。某研究所以粗氧化锌(含少量CuO、FeO、MnO、Fe2O3等)为原料,采用湿化学法(NPP-法)制备纳米级活性氧化锌,生产工艺流程如图:

已知:
①pH=5.4时,KMnO4的还原产物为MnO2。
②以上实验条件下各种氢氧化物沉淀的pH情况如下表所示。
Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | Mn(OH)2 | |
开始沉淀的pH | 7.5 | 2.2 | 5.2 | 6.4 | 8.6 |
沉淀完全的pH | 9.0 | 3.2 | 6.7 | 8.0 | 10.1 |
根据以上信息,回答下列问题:
(1)工艺过程中各步骤均用到的分离方法是_______________________________。
(2)“废渣1”的主要成分是______________________________________________。
(3)“反应器2”中两个氧化还原反应的离子方程式为_______________________________________________________________
(4) “反应器3”中加入锌粉的作用是________________________________。
(5)“反应器4”得到的废液中,含有的主要离子除了Na+外,还有______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出深蓝色的晶体[Cu(NH3)4]SO4·H2O。
(1)Cu2+基态核外电子排布式为________________________;[Cu(NH3)4]SO4·H2O中,不考虑空间构型,[Cu(NH3)4]2+的结构可用示意图表示为___________。
(2)乙醇分子中C原子轨道杂化类型为___________,H2O与H+以配位键形成H3O+,则H3O+的空间构型为__________(用文字描述)。
(3)N、O、S第一电离能由大到小的顺序为____________________。
(4)某含有结晶水的铜的氯化物的晶胞结构如图所示,该化合物的化学式是________。
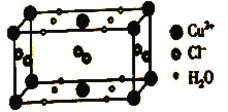
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电动汽车以锂电池提供动力,锂电池技术已经成为汽车研究的前沿科技某锂电池的电池反应为:xLi+Li3-xNiCoMnO6![]() Li3NiCoMnO6,下列说法正确的是
Li3NiCoMnO6,下列说法正确的是![]()
A. 该电池的充、放电过程互为可逆反应
B. 放电时,电池的负极反应为Li-e-=Li+
C. 放电过程中,Li+向电池的负极移动
D. 该电池可以采用醋酸、乙醇等作为电解质溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2005年10月12日北京时间上午9时,中国酒泉卫星发射中心成功将“神舟6号”飞船送入太空,这一壮举又一次受到世界关注.火箭推进器中有强还原剂液体肼(N2H4)和强氧化剂液态双氧水.当它们混合时,即产生大量氮气和水蒸气并放出大量热.已知:0.4mol液态肼与足量的液态双氧水反应生成氮气和水蒸气,放出256.652kJ的热量.
(1)反应的热化学方程
(2)又已知H2O(l)=H2O(g)△H=44kJ.mol﹣1 . 则16g液态肼与足量的液态双氧水反应生成氮气和液态水时放出的热量是kJ.
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外还有一个很大优点是 .
(4)燃料电池在航天器得到大量应用;科研人员新近开发出一种由甲醇、氧气以及强碱作电解质溶液的新型手机电池,充电一次可供手机连续使用一个月,据此请回答以下问题:
①甲醇是极,电极反应
②电池反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、U、W 是原子序数依次增大的前四周期元素。其中 Y 的原子核外有 7 种运动状态不同的 电子;X、Z 中未成对电子数均为 2;U 是第三周期元素形成的简单离子中半径最小的元素;W 的内层电 子全充满,最外层只有 1 个电子。请回答下列问题:
(1)U 在周期表中的位置 。X、Y、Z 的第一电离能从大到小的顺序是 (用元素符号表示,下同)。
(2)写出 W 的价电子排布图 。
(3)根据等电子体原理,可知化合物 XZ 的电子式是 。
(4)X、Y、Z的最简单氢化物的键角从大到小的顺序是 ( 用化学式表示), 原因 是 。
(5)由元素 Y 与 U 元素组成的化合物 A,晶胞结构如右图所示(黑球表示 Y 原子, 白球表示 U 原子),请写出化合物 A 的化学式 ,其中 Y 元素的杂化方式是 。
(6)U 的晶体属立方晶系,其晶胞边长为 405 pm,密度是 2.70 g/cm,通过计算确定 其晶胞的类型 (填简单立方堆积、体心立方堆积或面心立方最密堆 积)(已知:4053≈6.64×107)
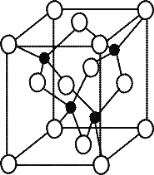
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某粗铜产品中含有Zn、Ag、Au等杂质,如图所示,用CH3OH-碱性燃料电池电解硫酸铜溶液。闭合电键K进行电解。下列说法中不正确的是( )
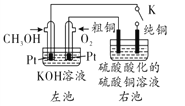
A. 左池负极反应式为CH3OH -6e-+8OH-=CO32-+ 6H2O
B. 通电一段时间后,Ag、Au杂质金属沉积在电解槽底部
C. 若粗铜电极质量减少6.4g,则纯铜电极增重大于6.4g
D. 电解过程中右池纯铜和粗铜分别为阴极和阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学反应速率说法中不正确的是( )
A.反应速率用于衡量化学反应进行的快慢
B.决定反应速率的主要因素是反应物的性质
C.可逆反应达到化学平衡状态时,正、逆反应的速率都为0
D.增大反应物的浓度、提高反应温度都能增大反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【选修5——有机化学基础】以芳香族化合物A和有机物D为原料,制备异戊酸薄荷醇酯(M)和高聚物(N)的一种合成路线如下图所示(部分反应条件已省略):

已知: I.A→B的原了利用率为100%;
II. ![]() (R1、R2表示氢原子或烃基)。
(R1、R2表示氢原子或烃基)。
请回答下列问题:
(1)用系统命名法对G命名,其化学名称为______________________。
(2)E的结构简式为____________________________。
(3)A→B的反应类型为_______。B分子中最多有____个原子共平面。
(4)C+G→M的化学方程式为_____________________________________。
(5)同时满足下列条件的B的同分异构体有______种(不考虑立体异构)。
①苯环上连有两个取代基 ②能发生银镜反应
(6)参照上述合成路线和信息,以苯乙烯为原料(无机试剂任选),设计制备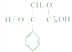 的合成路线______。
的合成路线______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com