

| ��Ӧ | �����̵� | ��ҵ�̵� | ||||
| �¶�/�� | 27 | 2000 | 25 | 350 | 400 | 450 |
| K | 3.84��10-31 | 0.1 | 5��108 | 1.847 | 0.507 | 0.152 |
| ʱ��/s | 0 | 20 | 40 | 60 | 80 |
| n��NO2��/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n��N2O4��/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
���� ��1����Ӧ���ܼ���-�������ܼ���=��Ӧ�ȣ��ݴ˼��㣻����Խ��ѧ��Խǿ��
��2��A����ѧƽ�ⳣ��˵����Ӧ���еij��׳̶����⣬�뷴Ӧ���е����׳̶��أ�
B�������̵��Ľ��г̶Ⱥ�С�����ô����̵�ԭ�����й�ҵ���ɣ����ʺ�С��
C���ϳɰ��Ƿ��ȷ�Ӧ���¶�Խ�ͣ�������ƽ��������Ӧ�ƶ�����Ӧ��ת����Խ�ߣ�
D����ѧƽ�ⳣ��˵����Ӧ���еij��׳̶����⣬�뷴Ӧ�����أ�
��3���ٸ��ݱ������ݼ��������������ķ�Ӧ���ʣ���������֮�ȵ��ڻ�ѧ������֮�ȼ�����������ķ�Ӧ���ʣ�
�ڷ�Ӧ�ﵽ60sʱ�ﵽ��ѧƽ��״̬��N2O4�����ʵ������ٱ仯�������ƽ��ʱ�����ʵ����ʵ����������������������������=$\frac{n��N{\;}_{2}O{\;}_{4}��}{n���ܣ�}$��100%���м��㣻
�ۺ�����������ܱ��������ٳ���0.32molHe�������������������Ϊ4L�������������������������Ũ�ȶ���С���൱�ڼ�Сѹǿ������V��������V���棩���ʶ���С��ƽ�����淴Ӧ�����ƶ���
��� �⣺��1��N��N����Ϊx����3��436kJ/mol+x-2��1173.2kJ/mol=-92.4kJ/mol�����x=946kJ/mol���ʶ���1mol N��N����Ҫ������946kJ��O=O������498kJ/mol���ʵ��������л�ѧ�������������еĻ�ѧ��ǿ��
�ʴ�Ϊ��946��ǿ��
��2��A����ѧƽ�ⳣ��˵����Ӧ���еij��׳̶����⣬�뷴Ӧ���е����׳̶��أ���A����
B�������̵��Ľ��г̶Ⱥ�С�����ô����̵�ԭ�����й�ҵ���ɣ����ʺ�С��û��ʵ�����壬��B��ȷ��
C���ϳɰ��Ƿ��ȷ�Ӧ���¶�Խ�ͣ�������ƽ��������Ӧ�ƶ�����Ӧ��ת����Խ�ߣ���ӦԽ��ȫ����C��ȷ��
D����ѧƽ�ⳣ��˵����Ӧ���еij��׳̶����⣬�뷴Ӧ�����أ���D����
�ʴ�Ϊ��BC��
��3�����ɱ������ݿ�֪���ӷ�Ӧ��ʼֱ��20sʱ��v��N2O4��=$\frac{\frac{0.05mol}{2L}}{20s}$=0.00125mol•L-1•S-1����v��NO2��=2v��N2O4��=2��0.00125mol•L-1•S-1=0.0025mol•L-1•S-1���ʴ�Ϊ��0.0025��
�ڷ�Ӧ�ﵽ60sʱ�ﵽ��ѧƽ��״̬��N2O4�����ʵ������ٱ仯��
���ݷ�Ӧ����ʽ���㣺2NO2 ?N2O4
��ʼ��0.4mol 0
ת����0.16mol 0.08mol
ƽ�⣺0.24mol 0.08mol
��ƽ����������������������Ϊ=$\frac{n��N{\;}_{2}O{\;}_{4}��}{n���ܣ�}$��100%=$\frac{0.08}{0.24+0.08}$��100%=25%��
�ʴ�Ϊ��25%��
�ۺ�����������ܱ��������ٳ���0.32molHe�������������������Ϊ4L�������������������������Ũ�ȶ���С���൱�ڼ�Сѹǿ������V��������V���棩���ʶ���С��ƽ�����淴Ӧ�����ƶ���V��������V���棩����ѡ��BC��
���� ���⿼�鷴Ӧ�ȵ��йؼ��㡢ƽ�ⳣ�����塢��ѧƽ���ƶ��Լ���ؼ��㣬��Ŀ��Ϊ�ۺϣ��漰����֪ʶ���ѶȽϴ�������ض�ѧ�������������ͽ��ⷽ����ָ����ѵ����ּ�ڿ���ѧ��������û���֪ʶ���ʵ�������������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1g H2��8 gO2 | |
| B�� | 0.1mol HCl ��2.24 L He | |
| C�� | 150�棬1.01��105Paʱ��18LH2O��18LCO2 | |
| D�� | ���³�ѹ��28gCO��6.02��1022��CO���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
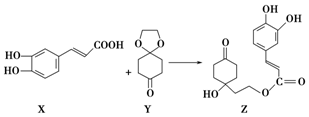
| A�� | X�ķ���ʽΪC9H8O4 | |
| B�� | Y��Z�о���1������̼ԭ�� | |
| C�� | Z�ܷ����ӳɷ�Ӧ��ȡ����Ӧ����ȥ��Ӧ | |
| D�� | 1 mol Z�������3 mol Br2����ȡ����Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 480mL | B�� | 1000mL | C�� | 100mL | D�� | 500mL |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ֽⷴӦ | B�� | �û���Ӧ | C�� | ���ֽⷴӦ | D�� | ���Ϸ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ | B�� | ���� | C�� | ��̪ | D�� | ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ���� | CH3OH | CH3OCH3 | H2O |
| c��mol•L-1�� | 0.46 | 1.0 | 1.0 |
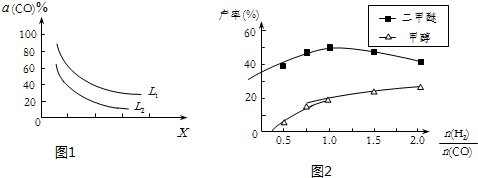
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com