
【题目】硝酸工业尾气中氮的氧化物NO、NO2被氢氧化钠溶液吸收的主要反应为:2NO2+2NaOH=NaNO2+NaNO3+H2O,NO2+NO+2NaOH=2NaNO2+H2O,现有aL(标准状况)NO和NO2混合气体被足量氢氧化钠溶液吸收,没有气体残余,下列说法不正确的是 ( )
A.实际参加反应的氢氧化钠的物质的量是a/22.4 mol
B.混合气体气体中NO2体积一定大于(等于)NO体积
C.溶液中NaNO3物质的量一定小于(等于)NaNO2物质的量
D.若生成的NaNO2与NaNO3的物质的量之比为3:1,则混合气体中NO与NO2的体积比为3:1
【答案】D
【解析】
A.aL(标准状况)NO和NO2混合气体的物质的量为![]() mol,被足量氢氧化钠溶液吸收,没有气体残余,根据N元素守恒可知生成NaNO2和NaNO3共
mol,被足量氢氧化钠溶液吸收,没有气体残余,根据N元素守恒可知生成NaNO2和NaNO3共![]() mol,由Na元素守恒可知消耗的NaOH的物质的量为
mol,由Na元素守恒可知消耗的NaOH的物质的量为![]() mol,故A正确;
mol,故A正确;
B.根据题目所给方程式可知只有NO2时气体可以完全被吸收,根据方程式NO2+NO+2NaOH=2NaNO2+H2O可知,当NO2的体积大于或等于NO时NO才能完全被吸收,而反应后气体没有剩余,所以混合气体中NO2体积一定大于(等于)NO体积,故B正确;
C.反应2NO2+2NaOH=NaNO2+NaNO3+H2O中生成的NaNO3和NaNO2物质的量相同,而只要有NO发生反应NO2+NO+2NaOH=2NaNO2+H2O就会使NaNO2物质的量大于NaNO3,故C正确;
D.设NaNO2与NaNO3的物质的量分别为3mol、1mol,则由2NO2+2NaOH=NaNO2+NaNO3+H2O可知,NO2的物质的量为2mol,生成NaNO2为1mol,故反应NO2+NO+2NaOH=2NaNO2+H2O中生成NaNO2为3mol-1mol=2mol,故该反应中NO2为1mol、NO为1mol,则NO2、NO的物质的量之比=(2mol+1mol):1mol=3:1,即NO与NO2的体积比为1:3,故D错误;
故答案为D。


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】硼氢化物NaBH4(B元素的化合价为+3价)燃料电池(DBFC), 由于具有效率高、产物清洁无污染和燃料易于储存和运输等优点,被认为是一种很有发展潜力的燃料电池。其工作原理如下图所示,下列说法正确的是
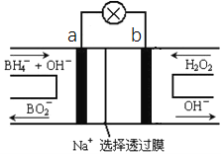
A. 电池的负极反应为BH4-+2H2O-8e-=BO2-+8H+
B. 放电时,每转移2mol电子,理论上需要消耗9.5gNaBH4
C. 电池放电时Na+从b极区移向a极区
D. 电极a采用MnO2,MnO2既作电极材料又有催化作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。吸收液吸收SO2的过程中,pH随n(Na2SO3):n(NaHSO3)变化关系如下表:
n(Na2SO3):n(NaHSO3) | 91:9 | 1:1 | 9:91 |
pH | 8.2 | 7.2 | 6.2 |
(1)由上表判断NaHSO3溶液显_____性,试解释原因______。
(2)pH=8.2的吸收液中由水电离出的c(OH-)______0.1molL-1NaOH溶液中由水电离出来的c(OH-)(填“>”、“<”或“=”)。
(3)将pH=8.2的吸收液蒸干得到固体的主要成分是______。
(4)若将等体积、等pH的NaOH溶液和Na2SO3溶液分别加水稀释m倍、n倍,稀释后两溶液pH仍相等,则m______n(填“<”、“>”或“=”)。
(5)25℃时,当吸收液为中性时,溶液中离子浓度关系正确的是______(选填字母)。
A c(Na+)=2c(SO![]() )+c(HSO
)+c(HSO![]() )
)
B c(Na+)>c(HSO![]() )>c(SO
)>c(SO![]() )>c(H+)=c(OH-)
)>c(H+)=c(OH-)
C c(Na+)+c(H+)=c(SO![]() )+c(HSO
)+c(HSO![]() )+c(OH-)
)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由A制备F的一种合成路线如图:
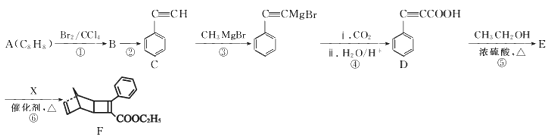
已知:![]()
(1)A的化学名称为___,D中官能团的名称是___。
(2)②、⑤的反应类型分别是___、___。
(3)②的反应条件是___,有机物X的结构简式为___。
(4)反应⑤的化学方程式为___。
(5)芳香化合物H是D的同分异构体,满足下列条件的同分异构体共有___种(不考虑立体异构);其中核磁共振氢谱为四组峰,峰面积比为1:2:2:1的结构简式为___。
a.能发生银镜反应b.含有-C≡CH结构c.无-C≡C-O-结构
(6)设计由1-丁炔和乙炔为原料制备化合物![]() 的合成路线:(无机试剂任选)___。
的合成路线:(无机试剂任选)___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,某恒容容器中发生可逆反应3H2(g)+N2(g) ![]() 2NH3 (g) ,下列叙述中能说明反应已达平衡状态的是
2NH3 (g) ,下列叙述中能说明反应已达平衡状态的是
A. 反应混合气体的质量不再变化B. 某一时刻测得![]()
C. 反应容器内气体体积不再变化D. 当生成0.3 mol H2的同时消耗了0.1mol N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是

A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验兴趣小组利用下列实验装置探究氯气与过量氨气反应的实验,有关说法不正确的是

A. 打开K1,关闭K2,将注射器的活塞往外拉一小段,然后松开,活塞复原,说明装置气密性良好
B. 打开K1,推动注射器的活塞使过量的氨气与氯气混合时,产生大量的白色烟雾
C. 充分反应后,关闭K1,打开K2,可观察到烧杯中的溶液会倒吸至试管内
D. 实验室制备氨气和氯气可以用同一套发生装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年6月27日,国务院发布《打赢蓝天保卫战三年行动计划》,该计划是中国政府部署的一项污染防治行动计划,旨在持续改善空气质量,为群众留住更多蓝天。对废气的进行必要的处理,让空气更加清洁是环境科学的重要课题。
(1)已知:N2(g)+O2(g)=2NO(g) △H1=+180.5kJ/mol
C (s)+O2(g)=CO2(g) △H2=-393.5kJ/mol
2C (s)+O2(g)=2CO(g) △H3=-221.0kJ/mol
若某反应的平衡常数表达式为![]() ,请写出此反应的热化学方程式_________________。
,请写出此反应的热化学方程式_________________。
(2)用如图所示的电解装置可将雾霾中的NO、SO2分别转化为NH![]() 和SO
和SO![]()

①写出物质A的化学式____________。
②NO在电极上发生的反应为 _________________。
SO2在电极上发生的反应为 __________________。
(3)工业上常用氨水吸收SO2,可生成NH4HSO3和(NH4)2SO3。
①某同学测得氨水吸收SO2所得溶液中NH4HSO3和(NH4)2SO3的物质的量之比恰好为2:1,写出该吸收过程的总反应方程式______________________________________。
②已知常温下H2S的电离常数Ka1=1.3×10-7,Ka2=7.1×10-15,将等物质的量浓度的NaHS与Na2S溶液等体积混合,所得溶液中离子浓度大小顺序为__________________。(用物质的量浓度符号由大到小排列)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下有关氨气的叙述中不正确的是( )
A.潮湿的氨气可以用浓硫酸干燥
B.氨的喷泉实验体现了氨的溶解性
C.氨具有还原性,一定条件下可与氧气发生反应
D.实验室里可用氨水与生石灰制取少量氨气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com