
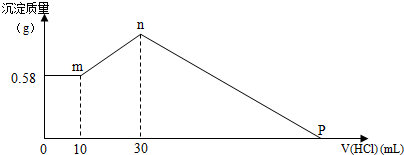
分析 (1)n点溶液中存在的溶质是氯化钠,根据原子守恒可知n(NaOH)=n(NaCl),则原混合物中n(NaOH)=n(NaCl)=n(Cl-)=2n(MgCl2)+3n(AlCl3)+n(HCl);生成氢氧化铝沉淀消耗20mL盐酸,根据方程式计算Al(OH)3的物质的量,再根据Al原子守恒计算n(AlCl3),并求其质量;由图可知,氢氧化镁的质量为0.58g,根据镁原子守恒计算n(MgCl2),并求其质量;
(2)P点溶液为MgCl2、AlCl3和NaCl混合液,由氯离子守恒可知,氯化钠中氯离子源于加入盐酸,根据钠离子守恒可知m(NaOH)=n(NaCl),进而计算加入盐酸的体积.
解答 解:(1)n点溶液中存在的溶质是氯化钠,由Na+离子和Cl-离子守恒得,原混合物中n(NaOH)=n(NaCl)=n(Cl-)=2n(MgCl2)+3n(AlCl3)+n(HCl)=0.01mol×2+0.01mol×3+0.03L×0.5mol/L=0.065mol,故NaOH的质量为0.065mol×40g/mol=2.6g,由[Al(OH)4]-+H+=Al(OH)3↓+H2O,则n[Al(OH)3]=n(HCl)=0.5mol/L×(0.03-0.01)L=0.01mol,根据铝原子守恒得n(AlCl3)=n[Al(OH)3]=0.01mol,故AlCl3的质量是0.01mol×133.5g/mol=1.335g;由图可知,氢氧化镁的质量为0.58g,其物质的量为$\frac{0.58g}{58g/mol}$=0.01mol,根据镁原子守恒:n(MgCl2)=n[Mg(OH)2]=0.01mol,故MgCl2的质量是0.01mol×95g/mol=0.95g,
故答案为:2.6;1.335;0.95;
(2)P点溶液为MgCl2、AlCl3和NaCl混合液,由氯离子守恒可知,氯化钠中氯离子源于加入盐酸,根据钠离子守恒可知m(NaOH)=n(NaCl)=0.065mol,C点加入盐酸的体积为$\frac{0.065mol}{0.5mol/L}$=0.13L=130mL,
故答案为:130.
点评 本题考查混合物有关计算,关键是明确每阶段发生的反应,侧重考查学生分析计算能力,注意利用守恒法计算解答,题目难度中等.


科目:高中化学 来源: 题型:选择题
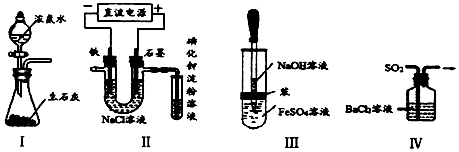
| A. | 实验Ⅰ:所示装置可制备氨气 | |
| B. | 实验Ⅱ:检验电解饱和食盐水的产物C12 | |
| C. | 实验Ⅲ:制取并观察Fe(OH)2沉淀 | |
| D. | 实验Ⅳ:吸收SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学平衡向正向移动,反应物浓度一定降低 | |
| B. | 化学平衡向正向移动,生成物的浓度一定增加 | |
| C. | 化学平衡向正向移动,反应物的转化率一定增大 | |
| D. | 化学平衡向正向移动时,正反应速率一定大于逆反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
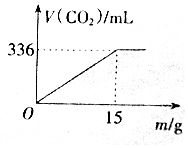 一定质量的铁碳合金在足量的氧气中燃烧,合金质量与生存二氧化碳体积(已换算为标准状况)关系如图所示,则此铁碳合金是( )
一定质量的铁碳合金在足量的氧气中燃烧,合金质量与生存二氧化碳体积(已换算为标准状况)关系如图所示,则此铁碳合金是( )| A. | 低碳钢 | B. | 中碳钢 | C. | 高碳钢 | D. | 合金钢 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 步骤 | 操作 | 现象 |
| 1 | 加入稀盐酸 | 溶解,无气泡 |
| 2 | 取步骤1中溶液,滴加K3[Fe(CN)6]溶液 | 蓝色沉淀 |
| 3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com