
(14分)乙醇是重要的化工原料和液体燃料,可以在一定条件下利用CO2与H2反应制得:
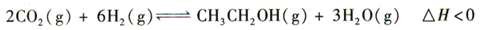
请回答:
(1)该反应的化学平衡常数表达式为 。
(2)当温度T1>T2时,化学平衡常数K1 K2(填“>”、“<”或“=”)。
(3)在恒温、恒容的密闭容器中,下列描述能说明上述反应已达化学平衡状态的是 (填字母序号)。
a.生成1molCH3CH2OH的同时生成3 mol H2O
b.容器中各组分浓度不随时间而变化
c.容器中混合气体的密度不随时间而变化
d.容器中气体的分子总数不随时间而变化
(4)在工业生产中,可使H2的转化率和化学反应速率同时提高的措施有 (写出一条合理措施即可)。
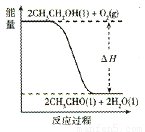
(5)工业上,常以乙醇为原料生产乙醛。根据下图所示信息,该反应是 反应(填“放热”或“吸热”),判断依据是__________________。
(6)乙醇可以作为燃料电池的燃料。某乙醇燃料电池以乙醇为燃料,使用酸性电解质,该电池负极反应的电极反应式为 。
(1)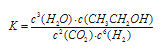
 (2)<
(3)b d
(2)<
(3)b d
(4)增大CO2浓度(或增大压强)
(5)放热 反应物总能量大于生成物总能量
(6)CH3CH2OH – 12 e- + 3H2O =2CO2 + 12H+
【解析】
试题分析:(1)根据化学平衡常数表达式的书写原则,该反应的化学平衡常数表达式见答案;(2)该反应正反应是放热反应,升高温度平衡向逆反应移动,平衡常数减小,即温度越高,平衡常数越小,温度T1>T2,K1<K2;(3)a.利用正逆反应速率相等作为平衡标志,注意“双向同时,符合比例”,生成1mol CH3CH2OH的同时,生成3mol H2O,都表示正反应速率,不能说明到达平衡,错误;b.可逆反应到达平衡时,各组分的物质的量不变,体系中各组份的物质的量浓度不随时间而变化,说明到达平衡,正确;c.反应混合气体的总质量不变,容器的体积不变,密度始终不变,体系中混合气体的密度不随时间而变化,不能说明到达平衡,错误;d.随反应进行混合气体总的物质的量减小,体系中气体的分子总数减少,体系中气体分子总数不随时间而变化,说明到达平衡,正确;选bd;(4)改变条件加快反应速率,同时平衡向正反应移动,可以增大CO2浓度或增大压强,反应速率加快,平衡向正反应移动氢气的转化率增大;(5)由图象可知,反应物的总能量大于生成物的总能量,故该反应物为放热反应;(6)燃料电池负极反应氧化反应,乙醇在负极放电,酸性条件下生成二氧化碳与氢离子,电极反应式为:CH3CH2OH-12 e-+3H2O=2CO2+12H+。
考点:考查平衡常数、化学平衡状态判断、化学平衡影响因素、燃料电池等。


科目:高中化学 来源: 题型:
| c(CH3OH)c3(H2O) |
| c2(CO2)c6(H2) |
| c(CH3OH)c3(H2O) |
| c2(CO2)c6(H2) |
| 温度/℃CO2转化率/% n(H2)/n(CO2) |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |

查看答案和解析>>
科目:高中化学 来源: 题型:
 (2012?湖南模拟)乙醇是重要的化工原料和液体燃料,可以在一定条件下利用CO2与H2反应制得:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H<0
(2012?湖南模拟)乙醇是重要的化工原料和液体燃料,可以在一定条件下利用CO2与H2反应制得:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H<0| c(CH3CH2OH)?c3(H2O) |
| c2(CO2)?c6(H2) |
| c(CH3CH2OH)?c3(H2O) |
| c2(CO2)?c6(H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| c3(H2O)?c(CH3OH) |
| c2(CO2)?c6(H2) |
| c3(H2O)?c(CH3OH) |
| c2(CO2)?c6(H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 乙醇是重要的化工原料和液体燃料,可以在一定条件下利用CO2与H2反应制取:
乙醇是重要的化工原料和液体燃料,可以在一定条件下利用CO2与H2反应制取:| c(CH3CH2OH)?c3(H2O) |
| c2(CO2)?c6(H2) |
| c(CH3CH2OH)?c3(H2O) |
| c2(CO2)?c6(H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| △ |
| c3(H2O)×c(CH3CH2OH) |
| c2(CO2)×c6(H2) |
| c3(H2O)×c(CH3CH2OH) |
| c2(CO2)×c6(H2) |
| 温度/℃CO2转化率/% n(H2)/n(CO2) |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com