

| A. | Pt周围的pH降低 | |
| B. | 当生成标准状况下22.4LH2时,转移的电子数为1.5 NA | |
| C. | 阳极反应式是Fe-6e-+8OH-═FeO42-+4H2O | |
| D. | 制得1mol Na2FeO4,有8molOH-从左向右通过离子交换膜 |
分析 整个装置用于制备高铁酸钠,根据装置图,其中阳极为Fe极,是活泼金属作为电极,注意介质是强碱性,因此电解时阳极发生反应:Fe-6e-+8OH-=FeO42-+4H2O,阴极发生反应:2H2O+2e-=2OH-+H2↑,据此分析.
解答 解:A.Pt电极为阴极,阴极是物质得到电子被还原,发生还原反应,考虑到溶液是碱性,因此阴极发生的电极反应为:2H2O+2e-=2OH-+H2↑,反应产生了OH-,因此Pt周围的pH升高,故A错误;
B.当生成标况下22.4LH2时,即H2的物质的量为$\frac{22.4L}{22.4L/mol}=1mol$,阴极发生的电极反应为:2H2O+2e-=2OH-+H2↑,因此反应转移的电子数为2mol,即2NA,故B错误;
C.阳极是Fe作为电极,是活性电极,在NaOH浓溶液中,电解生成Na2FeO4,因此阳极的电极反应式为:Fe-6e-+8OH-═FeO42-+4H2O,故C正确;
D.阳极反应式为:Fe-6e-+8OH-═FeO42-+4H2O,当值得1molNa2FeO4时,同时阳极生成8molOH-,根据电子守恒,此时阴极生成6molOH-,并没有8molOH-从左向右通过离子交换膜,故D错误.
故选C.
点评 本题考查电解原理,牢牢把握住电子守恒,分析电解时的离子运动规律,注意溶液是强碱性的,是OH-参与反应或生成OH-.题目难度不大,是基础题.


科目:高中化学 来源: 题型:选择题
| A. | 离子化合物里一定不存在共价键 | |
| B. | 共价化合物里一定不存在离子键 | |
| C. | 非极性键只存在于双原子的单质分子里 | |
| D. | 由不同元素组成的多原子分子里,一定只存在极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | CO、SO2、SO3均是酸性氧化物 | |
| B. | 图示转化反应均为氧化还原反应 | |
| C. | 工业上用氯气和石灰乳制取漂白粉的反应中原子利用率为100% | |
| D. | 严禁用工业酒精勾兑饮用酒是因为工业酒精中含有有毒的甲醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素Q是短周期非金属性最强的元素 | |
| B. | Y、Z形成的化合物中只有一种属于酸性氧化物 | |
| C. | Y、Z、Q分别与W形成的化合物中,Z形成的化合物的沸点最低 | |
| D. | X分别与Y、Z、W形成的化合物中可能既含离子键又含共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在强碱溶液中:Na+.K+.AlO2-.CO32- | |
| B. | 在含大量Fe3+的溶液中:NH4+.Na+.Cl-.SCN- | |
| C. | 在c(H+)=10-13mol/L 的溶液中:NH4+.Al3+.SO42-.NO3- | |
| D. | 在pH=1的溶液中:K+.Fe2+.Cl-.NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
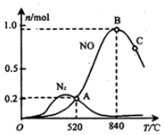 (1)科学家寻找高效催化剂,通过如下反应实现大气污染物转化:
(1)科学家寻找高效催化剂,通过如下反应实现大气污染物转化:| 化学键 | N≡N | O=O | NO中氮氧键 |
| 键能(kJ/mol) | 945 | 498 | 630 |
| 时间(min) | 0 | 5 | 10 | 15 | 20 | 25 |
| c(NH3)/mol•L-1 | 1.00 | 0.36 | 0.12 | 0.08 | 0.0072 | 0.0072 |
| c(O2)/mol•L-1 | 2.00 | 1.20 | 0.90 | 0.85 | 0.84 | 0.84 |
 ,羟胺是一种还原剂,现用25.00mL 0.049mol/L的羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+恰好与24.50mL0.020mol/L的KMnO4酸性溶液完全作用,则在上述反应中,羟胺的氧化产物是N2O.
,羟胺是一种还原剂,现用25.00mL 0.049mol/L的羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+恰好与24.50mL0.020mol/L的KMnO4酸性溶液完全作用,则在上述反应中,羟胺的氧化产物是N2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 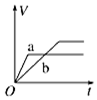 | B. | 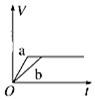 | C. | 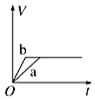 | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 五种元素中有两种金属元素 | |
| B. | 元素C、D、E的最高价氧化物对应水化物的酸性增强 | |
| C. | 元素D、E分别与元素A形成化合物的稳定性:A2D>AE | |
| D. | 元素B、D、E的简单离子半径大小为:B>D>E |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com