
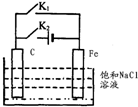
| A. | 断开 K2,闭合 K1时,Fe 电极反应为:2 H++2e-=H2↑ | |
| B. | 断开 K2,闭合 Kl 时,C电极反应为:2Cl--2e-=Cl2↑ | |
| C. | 断开 K1,闭合 K2时,Fe 电极反应为:Fe-2e-=Fe2+ | |
| D. | 断开 Kl,闭合 K2时,C电极反应为:2Cl--2e-=Cl2↑ |
分析 A、断开 K2,闭合 K1时,是原电池装置,活泼的铁是负极,失电子,发生氧化反应;
B、断开 K2,闭合 K1时,是原电池装置,是吸氧腐蚀,C是正极;
C、断开 K1,闭合 K2时,是电解池装置,铁与电源的负极相连是阴极,发生还原反应;
D、断开 K1,闭合 K2时,是电解池装置,C是阳极,还原性强的氯离子首先放电.
解答 解:A、断开 K2,闭合 K1时,是原电池装置,铁是负极发生氧化反应,所以电极反应式:Fe-2e-=Fe2+,故A错误;
B、断开 K2,闭合 K1时,是原电池装置,C电正极发生还原反应,是吸氧腐蚀,所以电极反应式为:O2+4e-+2H2O=4OH-,故B错误;
C、断开 K1,闭合 K2时,是电解池装置,铁是阴极发生还原反应,氢离子得电子,所以电极反应式为:2 H++2e-=H2↑,故C错误;
D、断开 K1,闭合 K2时,是电解池装置,C是阳极,氯离子放电,所以电极反应式为:2Cl--2e-=Cl2↑,故D正确;
故选:D.
点评 本题考查了原电池原理和电解池原理,为高频考点,侧重于学生的分析,能正确判断电池的类型及两极的反应是解本题的关键,题目难度中等.


科目:高中化学 来源: 题型:填空题
 目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.
目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.| 实验编号 | 实验目的 | T/℃ | NO初始浓度 mol/L | CO初始浓度 mol/L | 同种催化剂的比表面积m2/g |
| Ⅰ | 为以下实验作参照 | 280 | 6.50×10-3 | 4.00×10-3 | 80 |
| Ⅱ | 探究催化剂比表面积对尾气转化速率的影响 | 280 | 6.50×10-3 | 4.00×10-3 | 120 |
| Ⅲ | 探究温度对尾气转化速率的影响 | 360 | 6.50×10-3 | 4.00×10-3 | 80 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +2nH2O.
+2nH2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
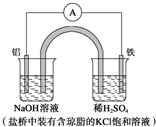
| A. | Fe作正极,发生氧化反应 | |
| B. | 负极反应:Al-3e-+3OH-═Al(OH)3↓ | |
| C. | 工作一段时间后,盛有稀硫酸溶液的杯中pH不变 | |
| D. | 盐桥中的Cl-向左边烧杯中移动,使该烧杯中溶液保持电中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com