
| »Æѧ¼ü | C-C | C-H | H-H | C-O | C”ŌO | O-H |
| ¼üÄÜ/kJ•mol-1 | 348 | 413 | 436 | 358 | x | 463 |
| Ąė×Ó | Cu2+ | H+ | Cl- | SO42 - |
| c/mol•L-1 | 0.5 | 2 | 2 | 0.5 |
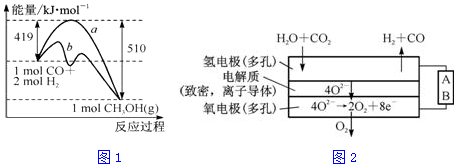
·ÖĪö £Ø1£©¢ŁŅŃÖŖ£ŗ¢ŁCH3OH£Øg£©=HCHO£Øg£©+H2£Øg£©”÷H=+84kJ/mol£»¢Ś2H2£Øg£©+O2£Øg£©=2H2O£Øg£©”÷H=-484kJ/mol£¬æÉĄūÓĆøĒĖ¹¶ØĀɽ«2”Į¢Ł+¢ŚµĆµ½CH3OH£Øg£©ÓėO2£Øg£©·“Ӧɜ³ÉHCHO£Øg£©ŗĶH2O£Øg£©µÄČČ»Æѧ·½³ĢŹ½£¬
£Ø2£©¢ŁøĆ·“Ó¦µÄ”÷S£¼0£»ĒśĻßaµ½ĒśĻßb£¬»ī»ÆÄܽµµĶ£¬æɼÓČė“߻ƼĮ£»
¢ŚŅĄ¾Ż»Æѧ·“Ó¦ģŹ±ä=·“Ó¦Īļ¼üÄÜ×ÜŗĶ-Éś³ÉĪļ¼üÄÜ×ÜŗĶĄ“·ÖĪö£»
£Ø3£©¢Ł¼×“¼Č¼ĮĻµē³ŲÖŠÕż¼«ÉĻŃõĘųµĆµē×ÓÉś³É¶žŃõ»ÆĢ¼£¬¼×“¼ŌŚøŗ¼«Ź§µē×Ó£¬¼īČÜŅŗÖŠÉś³ÉĢ¼ĖįŃĪ£»
¢Śµē½āŌĄķ£ŗŅõ¼«ÉĻĻŌŹ¾ĶĄė×ӵƵē×Ó£¬Č»ŗóŹĒĒāĄė×ӵƵē×Ó²śÉśĒāĘų£¬ŌŚŃō¼«ÉĻŹĒĀČĄė×ÓŹ§µē×ӵķ“Ó¦£¬²śÉśĀČĘų£¬Č»ŗóŹĒĒāŃõøłĄė×ÓŹ§µē×Ó²śÉśŃõĘų£¬Ņ»¶ĪŹ±¼äŗ󣬵±Į½¼«ŹÕ¼Æµ½ĻąĶ¬Ģå»ż£ØĻąĶ¬Ģõ¼ž£©µÄĘųĢåŹ±£¬øł¾Żµē×ÓŹŲŗć¼ĘĖćŃō¼«ÉĻŹÕ¼Æµ½ŃõĘųµÄÖŹĮ棻
£Ø4£©ÓÉĶ¼Ź¾æÉÖŖA¼«Ė®”¢¶žŃõ»ÆĢ¼Éś³ÉĒāĘų”¢CO£¬Ó¦·¢Éś»¹Ō·“Ó¦£¬ĪŖŅõ¼«·“Ó¦£®
½ā“š ½ā£ŗ£Ø1£©¢ŁŅŃÖŖ£ŗ¢ŁCH3OH£Øg£©=HCHO£Øg£©+H2£Øg£©”÷H=+84kJ/mol£»¢Ś2H2£Øg£©+O2£Øg£©=2H2O£Øg£©”÷H=-484kJ/mol£¬½«2”Į¢Ł+¢ŚµĆµ½CH3OH£Øg£©ÓėO2£Øg£©·“Ӧɜ³ÉHCHO£Øg£©ŗĶH2O£Øg£©µÄČČ»Æѧ·½³ĢŹ½ĪŖ2CH3OH£Øg£©+O2£Øg£©=2HCHO£Øg£©+2H2O£Øg£©”÷H=-316 kJ•mol-1£¬
¹Ź“š°øĪŖ£ŗ2CH3OH£Øg£©+O2£Øg£©=2HCHO£Øg£©+2H2O£Øg£©”÷H=-316 kJ•mol-1£»
£Ø2£©¢ŁøĆ·“Ó¦µÄ”÷S£¼0£»ĒśĻßaµ½ĒśĻßb£¬»ī»ÆÄܽµµĶ£¬Ó¦ĪŖ¼ÓČė“߻ƼĮ£¬
¹Ź“š°øĪŖ£ŗ£¼£»¼ÓČė“߻ƼĮ£»
¢ŚCO£Øg£©+2H2£Øg£©?CH3OH £Øg£©µÄģŹ±ä=·“Ó¦Īļ×ܼüÄÜÖ®ŗĶ-Éś³ÉĪļ×ܼüÄÜÖ®ŗĶ£¬ÉčCOÖŠĢ¼Ńõ¼üµÄ¼üÄÜĪŖX£¬½įŗĻĶ¼±ķĢį¹©µÄ»Æѧ¼üµÄ¼üÄÜ£¬Ōņ”÷HØTX+2”Į436KJ/mol-£Ø3”Į413KJ/mol+358KJ/mol+463KJ/mol£©=£Ø419-510£©kJ•mol-1=-91kJ•mol-1£¬½āµĆ£ŗX=1097KJ/mol£¬
¹Ź“š°øĪŖ£ŗ1097£»
£Ø3£©¢ŁČ¼ĮĻµē³Ų£¬µē³ŲµÄŅ»øöµē¼«ĶØ ČėæÕĘų£¬ĮķŅ»øöµē¼«ĶØČė¼×“¼ĘųĢ壬µē½āÖŹŹĒĒāŃõ»ÆÄĘČÜŅŗ£¬øł¾ŻŌµē³ŲŌĄķ£¬øŗ¼«µē¼«·“Ó¦ŹĒCH3OHŹ§Č„µē×ÓÉś³ÉĢ¼ĖįøłĄė×Ó-£ŗCH3OH-6e-+8OH-=CO32-+6H2O£¬
¹Ź“š°øĪŖ£ŗCH3OH-6e-+8OH-=CO32-+6H2O£»
¢ŚŅõ¼«ÉĻĻŌŹ¾ĶĄė×ӵƵē×Ó£¬Cu2++2e-=Cu£¬200mL0.5mol/LµÄĶĄė×ӵƵē×ÓĪļÖŹµÄĮæŹĒ0.2mol£¬Č»ŗóŹĒ2H++2e-=H2”ü£¬ŌŚŃō¼«ÉĻŹĒ0.4molĀČĄė×ÓŹ§µē×ӵķ“Ó¦£¬²śÉśĀČĘų0.2mol£¬2Cl--2e-=Cl2”ü£¬×ŖŅʵē×ÓŹĒ0.4mol£¬Č»ŗóŹĒĒāŃõøłĄė×ÓŹ§µē×Ó²śÉśŃõĘų£¬4OH--4e-=O2”ü+2H2O£¬µ±Į½¼«ŹÕ¼Æµ½ĻąĶ¬Ģå»ż£ØĻąĶ¬Ģõ¼ž£©µÄĘųĢåŹ±£¬¼ŁÉč²śÉśŃõĘųµÄĪļÖŹµÄĮæŹĒx£¬ŌŚŃō¼«ÉĻ²śÉśĘųĢåŹĒ£Ø0.2+x£©mol£¬øł¾Żµē×ÓŹŲŗć£¬µĆµ½0.4+4x=0.2+2£Ø0.2+x£©£¬½āµĆx=0.1mol£¬¼“Ńō¼«ÉĻŹÕ¼Æµ½ŃõĘųµÄÖŹĮæĪŖ3.2 g£¬
¹Ź“š°øĪŖ£ŗ3.2 g£»
£Ø4£©ÓÉĶ¼Ź¾æÉÖŖA¼«Ė®”¢¶žŃõ»ÆĢ¼Éś³ÉĒāĘų”¢CO£¬Ó¦·¢Éś»¹Ō·“Ó¦£¬ĪŖŅõ¼«·“Ó¦£¬ŌņAĪŖµēŌ“µÄøŗ¼«£¬Éś³ÉĒāĘųµÄ·“Ó¦ĪŖH2O+2e-=H2”ü+O2-£¬
¹Ź“š°øĪŖ£ŗøŗ¼«£»H2O+2e-=H2”ü+O2-£®
µćĘĄ ±¾Ģāæ¼²é½ĻĪŖ×ŪŗĻ£¬Éę¼°·“Ó¦ČČÓėģŹ±ä”¢»ÆŃ§Ę½ŗāµÄŅʶÆŅŌ¼°µē½āµČÖŖŹ¶£¬ĪŖøßæ¼³£¼ūĢāŠĶ£¬²ąÖŲӌѧɜµÄ·ÖĪöÄÜĮ¦ŗĶ¼ĘĖćÄÜĮ¦µÄ漲飬עŅā°ŃĪÕ·“Ó¦ČČµÄ¼ĘĖćŅŌ¼°µē½āµÄ¹¤×÷ŌĄķ£¬ÄѶČÖŠµČ£®


 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ģ¼ĖįøĘŹÜČČ·Ö½ā | B£® | ŅŅ“¼Č¼ÉÕ | C£® | ÄĘÓėĖ®µÄ·“Ó¦ | D£® | ĀĮČČ·“Ó¦ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā

| A£® | MµÄ·Ö×ÓŹ½ĪŖC9H10O4 | |
| B£® | MÓėÅØäåĖ®¼ČÄÜ·¢ÉśČ”“ś·“Ó¦£¬ÓÖÄÜ·¢Éś¼Ó³É·“Ó¦ | |
| C£® | Ņ»¶ØĢõ¼žĻĀ£¬1 mol M×ī¶ąÄÜÓė3molH2·¢Éś·“Ó¦ | |
| D£® | MÄÜ·Ö±šÓėNa”¢NaOH”¢NaHCO3·¢Éś·“Ó¦ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | FeCl2ÓŠŃõ»ÆŠŌ£¬ÄÜÓĆÓŚµńæĢµēĀ·°å | |
| B£® | ½šøÕŹÆŹĒ×ŌČ»½ēÖŠÓ²¶Č×ī“óµÄĪļÖŹ£¬²»ÓėŃõĘų·¢Éś·“Ó¦ | |
| C£® | Ć÷·Æ¼ÓČėĖ®ÖŠÄÜŠĪ³ÉAl£ØOH£©3½ŗĢ壬æÉÓĆ×÷¾»Ė®¼Į | |
| D£® | SiO2²»ÓėĒæĖį·“Ó¦£¬æÉÓĆŹÆÓ¢Ę÷ĆóŹ¢×°Ēā·śĖį |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĪČ¶ØŠŌ£ŗH2O£¼H2S£¼H2Se | |
| B£® | ½µĪĀÓŠĄūÓŚSeÓėH2·“Ӧɜ³ÉH2Se | |
| C£® | O2£Øg£©+2H2S£Øg£©ØT2H2O£Øg£©+2S£Øg£©”÷H=-444 kJ•mol-1 | |
| D£® | Ėę×ÅŗĖµēŗÉŹżµÄŌö¼Ó£¬VIA×åŌŖĖŲµ„ÖŹÓėH2µÄ»ÆŗĻ·“Ó¦Ō½ČŻŅ×·¢Éś |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ō×Ó°ė¾¶””A£¾B£¾D£¾C | B£® | Ō×ÓŠņŹż””d£¾c£¾b£¾a | ||
| C£® | Ąė×Ó°ė¾¶””C£¾D£¾B£¾A | D£® | ŅõĄė×ӵĻ¹ŌŠŌC2-£¼D- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ${\;}_{22}^{48}$TiŗĶ${\;}_{22}^{50}$TiÖŠ¾łŗ¬ÓŠ22øöÖŠ×Ó | |
| B£® | ${\;}_{22}^{48}$TiŗĶ${\;}_{22}^{50}$TiµÄ»ÆѧŠŌÖŹ²»Ķ¬ | |
| C£® | ${\;}_{22}^{48}$TiŗĶ${\;}_{22}^{50}$Ti»„³ĘĪŖĶ¬Ī»ĖŲ | |
| D£® | ${\;}_{22}^{48}$TiŗĶ${\;}_{22}^{50}$TiĪŖĶ¬Ņ»ŗĖĖŲ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 2NaHCO3$\frac{\underline{\;\;”÷\;\;}}{\;}$ Na2CO3+CO2”ü+H2O | B£® | H2SO4+CuOØTCuSO4+H2O | ||
| C£® | 2 H2S+SO2ØT3S”ż+2H2O | D£® | CO2+Ca£ØOH£©2ØTCaCO3”ż+H2O |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com