
下表中叙述Ⅰ和叙述Ⅱ均正确并且互为因果关系的是
选项 | 叙述Ⅰ | 叙述Ⅱ |
A | NH4Cl是强酸弱碱盐 | 将NH4Cl溶液蒸干可制备NH4Cl固体 |
B | Fe3+有强氧化性 | 用KSCN溶液可以鉴别Fe3+ |
C | SO2有还原性 | 用SO2可使溴水褪色 |
D | Cl2有漂白性 | 用Cl2可与石灰乳反应制备含氯消毒剂 |
 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源:2014-2015学年重庆市七校高三上学期期末联考理综化学试卷 (解析版) 题型:选择题
有关实验的叙述,正确的是
A.将浓硫酸加入容量瓶中溶解并稀释至刻度,配制成一定物质的量浓度的硫酸溶液
B.用玻璃棒蘸取溶液,点在湿润的pH试纸上测定溶液的pH值
C.用 溶液洗涤并灼烧铂丝后,再进行焰色反应
溶液洗涤并灼烧铂丝后,再进行焰色反应
D.读取量筒内液体的体积,俯视读数导致读数偏大
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省杭州地区7校高三上学期期末模拟联考化学试卷(解析版) 题型:填空题
(7分)NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,
用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛.请回答下列问题:
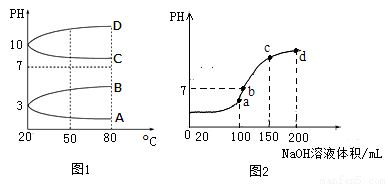
(1)相同条件下,相等物质的量浓度的NH4Al(SO4)2中c(NH4+) (填“=”、“>”“<”)NH4HSO4中c(NH4+)。
(2)如图1是0.1mol?L﹣1电解质溶液的pH随温度变化的图象。
①其中符合0.1mol?L﹣1 NH4Al(SO4)2的pH随温度变化的曲线是 (填写字母);
②室温时,0.1mol?L﹣1 NH4Al(SO4)2中2c(SO42﹣)﹣c(NH4+)﹣3c(Al3+)= mol?L﹣1(填数值)
(3)室温时,向100mL 0.1mol?L﹣1 NH4HSO4溶液中滴加0.1mol?L﹣1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示。试分析图中a、b、c、d四个点,水的电离程度最大的是 ;在b点,溶液中各离子浓度由大到小的排列顺序是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省杭州地区7校高三上学期期末模拟联考化学试卷(解析版) 题型:选择题
下列化学用语正确的是
A.HClO的电子式:
B.CH4分子的球棍模型:
C.硝基苯的结构简式:
D.中子数为10的氧原子:
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省益阳市高三上学期期中考试化学试卷(解析版) 题型:选择题
1.52 g铜镁合金完全溶解于50 mL密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4 的混合气体1120 mL (标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀,下列说法不正确的是
A.该合金中铜与镁的物质的量之比是2∶1
B.该浓硝酸中HNO3的物质的量浓度是14.0 mol/L
C.NO2和N2O4 的混合气体中,NO2 的体积分数是80%
D.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省益阳市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A.FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+=4Fe3++2H2O
B.过量石灰水与碳酸氢钙反应:Ca2++2HCO3-+2OH-===CaCO3↓+CO32-+2H2O
C.H218O中投入Na2O2固体:2H218O+2Na2O2===4OH-+4Na++18O2↑
D.向氯化铝溶液中滴加过量氨水:Al3++4NH3·H2O===AlO2-+4NH4++2H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省襄阳市高三1月调研理综化学试卷(解析版) 题型:填空题
[化学──选修3:物质结构与性质](15分)
稀土元素是指元素周期表中原子序数为57 到71 的15种镧系元素,以及与镧系元素化学性质相似的钪(Sc)和钇(Y)共17 种元素。稀土有“工业维生素”的美称,如今已成为极其重要的战略资源。
(1)钪(Sc)为21号元素,其基态原子M能层电子数为 。镝(Dy)的基态原电子排布式为[Xe]4f106s2,一个基态镝原子所含的未成对电子数为 。
(2)稀土元素最常见的化合价为+3价,但也有少数还有+4价。请根据下表中的电离能数据判断表中最有可能有+4价的元素是 。
几种稀土元素的电离能(单位:kJ·mol-1)
元素 | I1 | I2 | I3 | I1+I2+I3 | I4 |
Sc(钪) | 633 | 1235 | 2389 | 4257 | 7019 |
Y(钇) | 616 | 1181 | 1980 | 3777 | 5963 |
La(镧) | 538 | 1067 | 1850 | 3455 | 4819 |
Ce(铈) | 527 | 1047 | 1949 | 3523 | 3547 |
(3)离子化合物 Na3[Sc(OH)6]中,存在的作用力除离子键外还有 。
(4)Sm(钐)的单质与1,2-二碘乙烷可发生如下反应:Sm+ICH2CH2I→SmI2+CH2=CH2。ICH2CH2I中碳原子杂化轨道类型为 ,1mol CH2=CH2中含有的σ键数目为 。常温下1,2-二碘乙烷为液体而乙烷为气体,其主要原因是 。
(5)PrO2(二氧化镨)的晶体结构与CaF2相似,晶胞中Pr(镨)原子位于面心和顶点。则PrO2(二氧化镨)的晶胞中有 个氧原子。
(6)Ce(铈)单质为面心立方晶体,其胞参数为a=516pm。晶胞中Ce(铈)原子的配位数为 ,列式表示Ce(铈)单质的密度: g·cm-3(不必计算出结果)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省武汉市武昌区高三元月调考理综化学试卷(解析版) 题型:填空题
(13分)水是极弱的电解质,改变温度或加入某些电解质会影响水的电离。请回答下列问题:
(1)纯水在100 ℃时,pH=6,该温度下0.1 mol·L-1的NaOH溶液中,溶液的pH= 。
(2)25 ℃时,向水中加入少量碳酸钠固体,得到pH为11的溶液,其水解的离子方程式为 ,由水电离出的c(OH-)= mol·L-1。
(3)体积均为100 mL、pH均为2的盐酸与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,

则HX是 (填“强酸”或“弱酸”),理由是 。
(4)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
化学式 | 电离常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25 ℃时,等浓度的NaCN溶液、Na2CO3溶液和CH3COONa溶液,溶液的pH由大到小的顺序为 (填化学式)。
②25 ℃时,在0.5 mol/L 的醋酸溶液中由醋酸电离出的c(H+)约是由水电离出的c(H+)的 倍。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省等五校高三联考理综化学试卷(解析版) 题型:填空题
(16分)Heck反应是偶联反应的一种,例如:反应①:

化合物Ⅰ可以由以下途径合成:

(1)化合物Ⅱ的分子式为 ,1mol该物质最多可与 molH2发生加成反应。
(2)卤代烃CH3CHBrCH3发生消去反应可以生成化合物Ⅲ,相应的化学方程式为:
(注明条件)。
(3)化合物Ⅳ含有甲基且无支链的同系物Ⅵ的分子式为C4H6O,则化合物Ⅵ的结构简式为: 。
(4)化合物Ⅴ可与CH3CH2OH发生酯化反应生成化合物Ⅶ,化合物Ⅶ在一定条件下可以发生加聚反应,则其加聚产物的结构简式为: 。
(5)化合物Ⅱ的一种同分异构体Ⅷ能发生银镜反应,且核磁共振氢谱只有三组峰,峰面积之比为1:2:2,Ⅷ的结构简式为: 。
(6)一定条件下, 与
与 也可以发生类似反应①的反应,其有机产物的结构简式为: 。
也可以发生类似反应①的反应,其有机产物的结构简式为: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com