
分析 (1)铝粉和四氧化三铁反应生成氧化铝和铁;
(2)氯化铁具有氧化性氧化二氧化硫为硫酸;
(3)氢氧化铝不溶于弱酸弱碱,偏铝酸钠溶液中通入过量CO2反应生成氢氧化铝沉淀和碳酸氢钠;
(4)碳单质和浓硝酸加热反应生成二氧化氮、二氧化碳和水.
解答 解:(1)铝粉和四氧化三铁反应生成氧化铝和铁,反应的化学方程式为:8Al+3Fe3O4$\frac{\underline{\;高温\;}}{\;}$9Fe+4Al2O3,故答案为:8Al+3Fe3O4$\frac{\underline{\;高温\;}}{\;}$9Fe+4Al2O3
(2)氯化铁具有氧化性氧化二氧化硫为硫酸,反应的离子方程式为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;
故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;
(3)氢氧化铝不溶于弱酸弱碱,偏铝酸钠溶液中通入过量CO2反应生成氢氧化铝沉淀和碳酸氢钠,反应的离子方程式AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)碳单质和浓硝酸加热反应生成二氧化氮、二氧化碳和水,反应的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;
故答案为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
点评 本题考查物质性质的掌握,化学方程式的书写方法和注意问题,题目较简单.


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:推断题
 ;E的离子结构示意图
;E的离子结构示意图 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
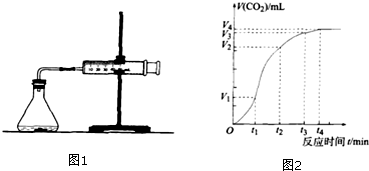
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
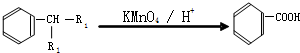
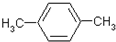 .
.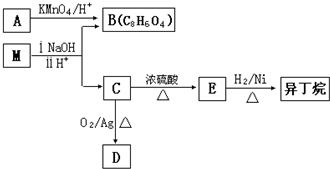
 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把铜片和铁片紧靠在一起浸入稀H2SO4中,铜片表面出现气泡 | |
| B. | 把铁钉和碳棒用铜线连接后,浸入0.1 mol•L-1的食盐溶液中,铁钉作负极被腐蚀 | |
| C. | 把铜片插入氯化铁溶液中,在铜片表面出现一层铁 | |
| D. | 把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气 | B. | 氦气 | C. | 氧气 | D. | 二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L | B. | 0.5mol/L | C. | 1mol/L | D. | 2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,1 mol Fe与足量稀HNO3反应,转移电子的数目为2 NA | |
| B. | 18 g D2O中含有的质子数目为10 NA | |
| C. | 标准状况下,22.4 L二氯甲烷的分子数约为NA | |
| D. | 28 g由C2H4和C3H6组成的混合物中含有氢原子的数目为4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
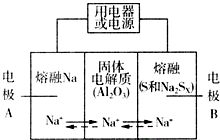 钠硫电池以熔融金属Na、熔融S和多硫化钠(Na2SX)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:Na2SX$?_{放电}^{充电}$ 2Na+XS (3<X<5)
钠硫电池以熔融金属Na、熔融S和多硫化钠(Na2SX)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:Na2SX$?_{放电}^{充电}$ 2Na+XS (3<X<5)| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com