
分析 根据n=$\frac{m}{M}$计算H2O和D2O的物质的量之比,发生反应2Na+2H2O=2NaOH+H2↑,2Na+2D2O=2NaOD+D2↑,根据方程式可知生成H2、D2的物质的量之比等于H2O和D2O的物质的量之比,相同体积气体体积之比等于其物质的量之比.
解答 解:质量相同的H2O和D2O的物质的量之比为$\frac{1}{18}$:$\frac{1}{20}$=10:9,由2Na+2H2O=2NaOH+H2↑、2Na+2D2O=2NaOD+D2↑,可知H2、D2的物质的量之比等于H2O和D2O的物质的量之比,即H2、D2的物质的量之比为10:9,相同体积气体体积之比等于其物质的量之比,故H2、D2的体积之比为10:9,
故答案为:10:9.
点评 本题考查化学方程式有关计算,比较基础,明确发生的反应即可解答,侧重对基础知识的理解巩固.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
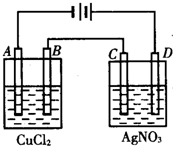 如图为以惰性电极进行电解:
如图为以惰性电极进行电解:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的电子式: | |
| B. | 氮原子的L层电子轨道表示式: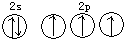 | |
| C. | 硫离子的核外电子排布式:1s22s22p63s23p4 | |
| D. | 碳-12原子:126C |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 在某一容积为5L的密闭容器内,加入0.2mol的CO和0.2mol 的H2O(g),在催化剂存在的条件下高温加热,发生如下反应:CO(g)+H2O(g)═CO2(g)+H2(g),反应放出热量.反应中CO2的浓度随时间变化的情况如图所示:
在某一容积为5L的密闭容器内,加入0.2mol的CO和0.2mol 的H2O(g),在催化剂存在的条件下高温加热,发生如下反应:CO(g)+H2O(g)═CO2(g)+H2(g),反应放出热量.反应中CO2的浓度随时间变化的情况如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是( )
如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是( )| A. | ①②③ | B. | ②④ | C. | ②③④ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 吸收塔中的硫元素可能以单质形式存在 | |
| B. | 中和池中只发生生成沉淀的复分解反应 | |
| C. | 在中和池中加入盐酸酸化的BaCl2溶液,可能产生白色沉淀 | |
| D. | 由题意分析得到,沉淀可能是Cr(OH)6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com