
【题目】对于可逆反应2SO2(g)+ O2(g)![]() 2SO3(g);△H<0,在一恒容容器中,由SO2和O2开始反应,下列说法正确的是
2SO3(g);△H<0,在一恒容容器中,由SO2和O2开始反应,下列说法正确的是
A.充入N2,容器内压强增大,增加了单位体积内活化分子数,反应速率加快
B.反应进行的净速率是正、逆反应速率之差
C.O2的消耗速率与SO3的生成速率之比为2:1
D.加入SO2,可使单位体积内活化分子百分比增多,加快反应速率
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:
【题目】海洋中的珊瑚虫经如下反应形成石灰石外壳,进而形成珊瑚:Ca2+ + 2HCO3- ![]() CaCO3↓ + H2O + CO2 。与珊瑚虫共生的藻类会消耗海洋中的CO2。气候变暖、温室效应的加剧干扰了珊瑚虫的生长,甚至致其死亡。下列说法不合理的是
CaCO3↓ + H2O + CO2 。与珊瑚虫共生的藻类会消耗海洋中的CO2。气候变暖、温室效应的加剧干扰了珊瑚虫的生长,甚至致其死亡。下列说法不合理的是
A.共生藻类消耗CO2,有利于珊瑚的形成
B.海洋中CO2浓度升高,抑制了珊瑚的形成
C.温度升高会增大CO2在海水中的溶解度,抑制了珊瑚的形成
D.将CO2转化为甲醇等化工原料,有助于缓解温室效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“3G”手机出现后,以光导纤维为基础的高速信息通道尤显重要.下列物质中用于制造光导纤维的材料是( )
A.铜合金 B.陶瓷 C.聚乙烯 D.二氧化硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电离平衡常数是衡量弱电解质电离程度的量。已知如下表数据(25 ℃):
化学式 | 电离平衡常数 |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.4×10-7,K2=4.7×10-11 |
(1)25 ℃时,等浓度的三种溶液(A.NaCN溶液、B.Na2CO3溶液、C.CH3COONa溶液)的pH由大到小的顺序为________________________________。(填写序号)
(2)25 ℃时,向NaCN溶液中通入少量CO2,所发生反应的化学方程式为______ ___。
(3)现有浓度为0.02 mol/L的HCN与0.01mol/L NaOH等体积混合后,测得c(Na+)>c(CN-),下列关系正确的是 。
A.c(H+)>c(OH-)
B.c(H+)<c(OH-)
C.c(H+)+c(HCN) = c(OH-)
D.c(HCN)+ c(CN-)=0.01mol/L
(4)浓的Al2(SO4)3溶液和浓的小苏打(NaHCO3)溶液混合可用于灭火,请用离子反应方程式表示灭火的原理_____________________。
(5)已知NaHC2O4水溶液显酸性,请写出该溶液中各离子浓度的大小___________________;电荷守恒表达式 ___________________ 。
(6)H2C2O4溶液和KMnO4酸性溶液可发生反应:H2C2O4+MnO4-+H+→CO2+Mn2++H2O,反应中每生成标况下4.48LCO2气体,转移的电子的物质的量为__________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种清洁能源,又是合成氨工业的重要原料。
(1)已知:CH4(g)+H2O==CO+3H2(g) △H=206.2 kJ·mol-1。
CH4(g)+CO2(g)==2CO(g)+2H2(g) △H=247.4 kJ·mol-1
甲烷和H2O(g)反应生成H2和CO2的热化学方程式为___________________。
(2)工业合成氨的反应原理为N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4 kJ·mol-1。
2NH3(g) △H=-92.4 kJ·mol-1。
某温度下,把10 mol N2与28 mol H2置于容积为10 L的密闭容器内,10 min时反应达到平衡状态,测 得氮气的平衡转化率为60%,则10 min内该反应的平均速率v(NH3)=__________mol·L-1·min-1,该温度下该反应的平衡常数K=________。 欲增大氮气的平衡转化率,可采取的措施有_____________、____________等(共写两条措施即可,每空一条)。
(3)下图所示装置工作时均与H2有关。
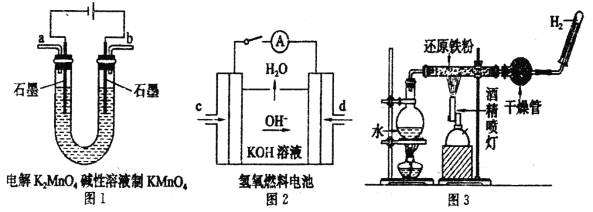
图l所示装置中阳极的电极反应式为______________。
②图2所示装置中,通入H2的管口是_____________(选填字母代号)。
③某同学按图3所示装置进行实验,实验结束后.将玻璃管内固体物质冷却后,溶于稀硫酸,充分反应后,滴加KSCN溶液。溶液不变红,再滴入新制氯水,溶液变为红色。该同学据此得出结论:铁与水蒸气反应生成FeO和H2。该结论_____________(填“严密”或“不严密”),你的理由是(用离子方程式和必要的文字说明)______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质在溶液中的行为是化学研究的重要内容。下列有关溶液的叙述不正确的是
A.加热蒸干NaCl、MgCl2溶液时可以得到晶体NaCl、MgCl2
B.相同条件下,等物质的量浓度的溶液导电能力:HC1>NH3·H2O
C.溶液中离子结合质子(氢离子)的能力:C2O42—>HC2O4—>SO42—
D.海洋封存CO2会导致局部海洋水体酸性增强,会破坏海洋生态环境
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知C8H11N的同分异构体中含有苯环的有很多种(不考虑立体异构),其中苯环上有一个侧链、二个侧链和三个侧链的种数分别是
A.5、9、6 B.4、6、6 C.3、9、7 D.4、6、7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓H2SO4(密度为1.84g/cm3)配制1 mol/L的稀H2SO4 90 mL,配制过程中需用仪器的先后顺序是( )
①20 mL量筒 ②10 mL量筒 ③50 mL烧杯 ④托盘天平 ⑤100 mL容量瓶 ⑥胶头滴管 ⑦玻璃棒
A.①③⑤⑥⑦ B.②③⑦⑤⑥
C.②⑤⑦⑥① D.④③⑦⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com