
| A. | NaOH | B. | CaBr2 | C. | H2 | D. | H2S |
分析 离子键指带相反电荷离子之间的相互作用,离子键属于化学键,大多数的盐,碱,活泼金属氧化物都有离子键.一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,据此解答.
解答 解:A.NaOH中钠离子和氢氧根离子之间存在离子键,氢氧根离子中O与H之间存在共价键,故A错误;
B.钙离子与溴离子之间存在离子键,故B正确;
C.H2中只存在非极性键,没有离子键,故C错误;
D.H2S中S和H两种非金属元素通过共用电子对结合形成的,因此H2S只含有共价键,故D错误;
故选:B.
点评 本题考查了离子键和共价键的判断,根据离子键和共价键的概念来分析解答即可,注意稀有气体中不存在化学键,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
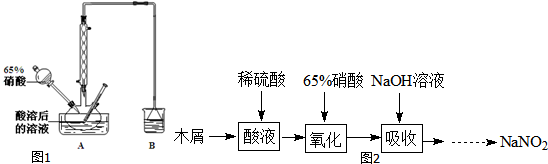
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤⑥ | B. | ①② | C. | ③⑤ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
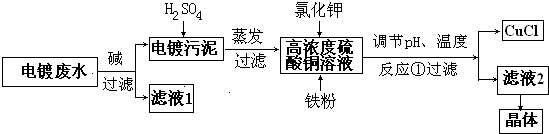
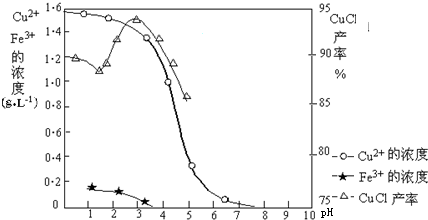
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S区、第五周期、ⅠA族 | B. | ds区、第五周期、ⅠB族 | ||
| C. | d区、第四周期、ⅠB族 | D. | ds区、第五周期、ⅠA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知:①CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ•mol-1
已知:①CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ•mol-1| A. | 通常状况下,氢气的燃烧热为241.8 kJ•mol-1 | |
| B. | 由①可知,1 mol CO(g)和$\frac{1}{2}$mol O2(g)反应生成1 mol CO2(g),放出283.0 kJ的热量 | |
| C. | 可用右图表示2CO2(g)═2CO(g)+O2(g)反应过程中的能量变化关系 | |
| D. | 分解1 mol H2O(g),其反应热为-241.8 KJ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
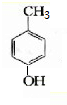 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com