
相同容积的四个密闭容器中,进行同样的可逆反应2A (g) +B(g)  3C(g)+2D(g)
,起始时四个容器内所装A、B的量如下:
3C(g)+2D(g)
,起始时四个容器内所装A、B的量如下:
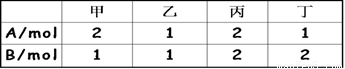
在相同温度下建立平衡时,A或B的转化率α的大小关系为( )
A、A的转化率:甲<丙<乙<丁 B、A的转化率:甲<乙<丙<丁
C、B的转化率:甲>乙>丙>丁 D、B的转化率:丁>乙>丙>甲
AC
【解析】 此题考查的知识点是反应物的数值对转化率大小的影响。我们可以以乙、丙为基准,先比较它们两组A、B转化率的大小,再与甲、乙两组比较.丙组的A、B都为乙组的两倍,两容器的容积相同,所以丙容器的压强比乙容器的压强大,此反应正方向为气体体积增大的反应,压强大则化学平衡向逆反应方向移动,所以丙组的A、B的转化率都比乙组的小。
将甲组和乙组相比,B相同,A物质甲组比乙组多1mol,可看作甲组为在乙组的基础上增加了1molA,我们知道:增加A物质的量,其他反应物如B的转化率增大,A本身的转化率减小.所以A的转化率甲<乙,B的转化率甲>乙 。
同理,丙组与甲组相比,A相同,B物质丙组比甲组多1mol,所以A的转化率甲<丙,B的转化率甲>丙。乙组与丁组相比,A相同,B物质丁组比乙组要多1mol,所以A的转化率乙<丁,B的转化率乙>丁。丙组与丁组相比,B相同,A物质丙组比丁组多1mol,所以A的转化率丙<丁,B的转化率丙>丁。
通过以上比较可得出结论:A的转化率甲<丙<乙<丁;B的转化率甲>乙>丙>丁所以正确的答
案选AC。


科目:高中化学 来源: 题型:阅读理解
 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义.| c(CH3OH)c(H2O) |
| c(CO2)c3(H2) |
| c(CH3OH)c(H2O) |
| c(CO2)c3(H2) |
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (2011?郑州二模)利用所学化学反应原理,解决以下问题:
(2011?郑州二模)利用所学化学反应原理,解决以下问题:| H | + 4 |
| H | + 4 |
 NH3?H2O+H+
NH3?H2O+H+ NH3?H2O+H+
NH3?H2O+H+| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol H2、1mol I2 | 2 mol HI | 4 mol HI |
| HI的浓度(mol?L-1) | C1 | C2 | C3 |
| 反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
| 反应物转化率 | a1 | a2 | a3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
利用所学化学反应原理,解决以下问题:
(1)某溶液含两种相同物质的量的溶质,且其中只存在OH一、H+、![]() 、Cl一四种离子,且c(
、Cl一四种离子,且c(![]() )>c(Cl-)>c(OH-)>c(H+),则这两种溶质是_____________。
)>c(Cl-)>c(OH-)>c(H+),则这两种溶质是_____________。
(2)0.1 mol·L-1的氨水与0.05 mol·L-1的稀硫酸等体积混合,用离子方程式表示混合后溶液的酸碱性:______________________。
(3)已知:Ksp(RX)=1.8×10-10,Ksp(RY)=1.5×10-16,Ksp(R2Z)=2.0×10-12,则难溶盐RX、RY和R2Z的饱和溶液中,R+浓度由大到小的顺序是_____________。
(4)以石墨电极电解100 mL 0.1 mol·L-1CuSO4溶液。若阳极上产生气体的物质的量为0.01 mol,则阴极上析出Cu的质量为__________g。
(5)向20 mL硫酸和盐酸的混合液中逐滴加入pH=13的Ba(OH)2溶液,生成BaSO4的量如右图所示,B点溶液的pH=7(假设体积可以直接相加),则c(HCl)=_______mol·L-1.

(6)在温度、容积相同的3个密闭容器中,按下表投入反应物,发生反应(H2(g)+I2(g)![]() 2HI(g) △H=-14.9 kJ·mol-1),在恒温、恒容条件下,测得反应达到平衡时的数据如下表:
2HI(g) △H=-14.9 kJ·mol-1),在恒温、恒容条件下,测得反应达到平衡时的数据如下表:

下列说法正确的是_______________。
A.![]() +
+![]() =1 B.2
=1 B.2![]() =
=![]() C.a+b=14.9 D.c1=c2=c3
C.a+b=14.9 D.c1=c2=c3
查看答案和解析>>
科目:高中化学 来源: 题型:
利用所学化学反应原理,解决以下问题:
(1)某溶液含两种相同物质的量的溶质,且其中只存在OH一、H+、![]() 、Cl一四种离子,且c(
、Cl一四种离子,且c(![]() )>c(Cl-)>c(OH-)>c(H+),则这两种溶质是_____________。
)>c(Cl-)>c(OH-)>c(H+),则这两种溶质是_____________。
(2)0.1 mol·L-1的氨水与0.05 mol·L-1的稀硫酸等体积混合,用离子方程式表示混合后溶液的酸碱性:______________________。
(3)已知:Ksp(RX)=1.8×10-10,Ksp(RY)=1.5×10-16,Ksp(R2Z)=2.0×10-12,则难溶盐RX、RY和R2Z的饱和溶液中,R+浓度由大到小的顺序是_____________。
(4)以石墨电极电解100 mL 0.1mol·L-1CuSO4溶液。若阳极上产生气体的物质的量为0.01 mol,则阴极上析出Cu的质量为__________g。
(5)向20 mL硫酸和盐酸的混合液中逐滴加入pH=13的Ba(OH)2溶液,生成BaSO4的量如右图所示,B点溶液的pH=7(假设体积可以直接相加),则c(HCl)=_______mol·L-1.
(6)在温度、容积相同的3个密闭容器中,按下表投入反应物,发生反应(H2(g)+I2(g)![]() 2HI(g) △H=-14.9 kJ·mol-1),在恒温、恒容条件下,测得反应达到平衡时的数据如下表:
2HI(g) △H=-14.9 kJ·mol-1),在恒温、恒容条件下,测得反应达到平衡时的数据如下表:
下列说法正确的是_______________。
A.![]() +
+![]() =1 B.2
=1 B.2![]() =
=![]() C.a+b=14.9 D.c1=c2=c3
C.a+b=14.9 D.c1=c2=c3
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省东阳市南马高中高三下学期期中考试化学试卷 题型:填空题
(12分)利用所学化学反应原理,解决以下问题:
(1)某溶液含两种相同物质的量的溶质,且其中只存在OH一、H+、NH4+、Cl一四种离子,
且c(NH4+)>c(Cl-)>c(OH-)>c(H+),则这两种溶质是 。
(2)0.1 mol·L-1的氨水与0.05 mol·L-1的稀硫酸等体积混合,用离子方程式表示混合后溶液的酸碱性: 。
(3)已知:Ksp(RX)=1.8×10-10,Ksp(RY)=1.5×10-16,Ksp(R2Z)=2.0×10-12,则难溶盐RX、RY和R2Z的饱和溶液中,R+浓度由大到小的顺序是 。
(4)向20 mL硫酸和盐酸的混合液中逐滴加入pH=13的Ba(OH)2溶液,生成BaSO4的量
如右图所示,B点溶液的pH=7(假设体积
可以直接相加),则c(HCl)= mol·L-1.
(5)在温度、容积相同的3个密闭容器中,
按下表投入反应物,发生反应(H2(g)+
I2(g) 2HI(g) △H=-14.9 kJ·mol-1),在恒温、恒容条件下, 测得反应达
2HI(g) △H=-14.9 kJ·mol-1),在恒温、恒容条件下, 测得反应达
到平衡时的数据如下表:
下列说法正确的是 。
A. + + =1 =1 | B.2 = = | C.a+b=14.9 | D.c1=c2=c3 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com