


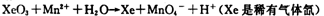




 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源:不详 题型:填空题
| A.把盛有溶液的分液漏斗敖在铁架台的铁圈中: |
| B.把50mL碘水和15mL四氯化碳加入分液漏斗中,并盖好玻璃塞: |
| C.检验分液漏斗活塞和上口玻璃塞是否漏液; |
| D.倒转漏斗,用力振荡,并不时旋开活塞放气,最后关闭活塞: |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Na3AlH6+2Al+3H2↑。下列说法正确的是
Na3AlH6+2Al+3H2↑。下列说法正确的是| A.NaAlH4中氢元素为+1价 |
| B.每生成11. 2 L(标准状况下)H2,转移2NA个电子 |
| C.在反应中有50%的氢被氧化 |
| D.反应中氧化产物与还原产物的物质的量之比为1: 1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用稀硝酸洗去附在试管内壁的银镜 |
| B.用热的纯碱溶液清洗油污 |
| C.用新制的氢氧化铜悬浊液与病人的尿液混和加热,来检验病人是否患糖尿病 |
| D.在铁质镀件上镀铜 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①③⑤ | B.①②④⑤ | C.①②③④ | D.只有①③ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 6Cu+SO2↑。对于该反应,下列说法中正确的是( )
6Cu+SO2↑。对于该反应,下列说法中正确的是( )| A.该反应中的氧化剂只有Cu2O |
| B.氧化产物和还原产物的物质的量之比为6:1 |
| C.Cu既是氧化产物又是还原产物 |
| D.Cu2S在反应中既是氧化剂又是还原剂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 ,其中H2SO3的还原性最强,KMnO4的氧化性最强。对此反应体系:
,其中H2SO3的还原性最强,KMnO4的氧化性最强。对此反应体系:
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com