
【题目】A、B、C、D、E代表5种元素。请填空:
(1)A元素基态原子的最外层有1个未成对电子,次外层有2个电子,其元素符号为____。
(2)B元素是前四周期基态原子中的未成对电子数最多的,其基态原子的价电子排布图为_____。
(3)C元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,该电子的轨道形状为_____,C的基态原子核外电子占用了_____个原子轨道,被其占用的最外电子层本身有_____个能级。
(4)D元素是自然界中含量居第二位的金属元素,其+3价离子简化的核外电子排布式为______,该离子比同元素的其它离子更稳定的原因是_____。
(5)E元素原子最外层电子数是电子层数的3倍,其核外共有_____种能量不同的电子,写出E的具有18个电子的氢化物的电子式:_____。
【答案】Li、B或F ![]() 球形 15 4 [Ar]3d5 最外层3d能级电子排布半充满,能量更低,更稳定 3
球形 15 4 [Ar]3d5 最外层3d能级电子排布半充满,能量更低,更稳定 3 ![]()
【解析】
(1)A元素基态原子的最外层有1个未成对电子,次外层有2个电子,则A为第二周期元素;
(2)前四周期基态原子中,B元素的未成对电子数最多,则处于第四周期,价电子排布式为3d54s1,故B为Cr;
(3)C元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,原子核外电子排布为1s22s22p63s23p63d104s1,故C为Cu元素。
(4)自然界中含量前4位元素分别为O、Si、Al、Fe,其中Al、Fe为金属元素;
(5)E元素原子最外层电子数是电子层数的3倍,则基态E原子的电子排布式为1s22s22p4,E为O元素。
(1)A元素基态原子的最外层有1个未成对电子,次外层有2个电子,则A为第二周期元素,满足条件的有Li、B和F三种元素;
(2)B元素是前四周期基态原子中的未成对电子数最多的,价电子排布式为3d54s1,则B为Cr,其基态原子的价电子排布图为![]() ;
;
(3)C元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,原子核外电子排布为1s22s22p63s23p63d104s1,故C为Cu元素;未成对电子为4s1,该电子的轨道形状为球形;基态Cu原子占用的原子轨道数为1+1+3+1+3+5+1=15;被其占用的最外电子层为第四层,有s、p、d、f共4个能级;
(4)自然界中含量前4位元素分别为O、Si、Al、Fe, D元素是自然界中含量居第二位的金属元素,则D为Fe元素;Fe3+简化的核外电子排布式为[Ar]3d5,该离子比同元素的其它离子更稳定的原因是最外层3d能级电子排布半充满,能量更低,更稳定;
(5)E元素原子最外层电子数是电子层数的3倍,则基态E原子的电子排布式为1s22s22p4,E为O元素,其核外共有3种能量不同的电子;O和H形成的18个电子化合物为H2O2,电子式为![]() 。
。


 培优口算题卡系列答案
培优口算题卡系列答案科目:高中化学 来源: 题型:
【题目】下列有关氨的叙述中不正确的是( )
A. 氨分子中氮元素的化合价只能升高,氨具有还原性
B. 氨的催化氧化反应的化学方程式是4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
C. 氨的催化氧化反应中若氧气过量则有红棕色气体生成
D. 氨的催化氧化属于人工氮的固定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组制备氯气并对产生氯气的条件进行探究。

(1)装置A中用MnO2与浓盐酸反应制取Cl2,利用了浓HCl的___________(填“氧化性”或“还原性”)。
(2)A中产生的气体不纯,含有的杂质可能是___________。
(3)B用于收集Cl2,请完善装置B并用箭头标明进出气体方向_____________。
(4)C用于吸收多余的Cl2,C中发生反应的离子方程式是____________________________________________________________。
(5)该小组欲研究盐酸的浓度对制Cl2的影响,设计实验进行如下探究。

①已知MnO2呈弱碱性。 Ⅰ中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,化学方程式是___________________________________________________。
②Ⅱ中发生了分解反应,反应的化学方程式是__________________________________。
③Ⅲ中无明显现象的原因,可能是c(H+)或c(Cl-)较低,设计实验Ⅳ进行探究:

将实验Ⅲ、Ⅳ作对比,得出的结论是____________________________;
将ⅰ、ⅱ作对比,得出的结论是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组采用电渗析法从含NH4H2PO4和(NH4)2HPO4的废水中回收NH3·H2O和H3PO4,装置如图所示。下列说法错误的是( )
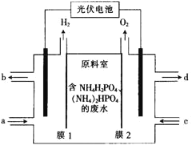
A.膜1为阳离子交换膜,膜2为阴离子交换膜
B.每放出11.2L(标准状况)H2时,能回收98gH3PO4
C.阴极区总反应式为2H2O+2NH4++2e-=2NH3·H2O+H2↑
D.a处进入稀氨水,d处流出浓H3PO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学一选修3:物质结构与性质)
氧化亚铜(Cu2O)可用于陶瓷、固体整流器。可用反应制备:2(CuSO4·5H2O) ![]() Cu2O+SO2↑+SO3↑+O2↑+10H2O。回答下列问题:
Cu2O+SO2↑+SO3↑+O2↑+10H2O。回答下列问题:
(1)Cu2O中基态铜的离子的价层电子排布图为_______________。在高温下CuO能分解生成Cu2O,试从原子结构角度解释其原因__________________。
(2)已知H2SO4的结构式如图所示: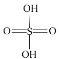 。上述反应中:
。上述反应中:
①在上述产物中,VSEPR模型与硫酸相同的是_________(填化学式,下同),与NO3-互为等电子体的一种分子是________。
②SO32-的杂化类型是________,请比较键角的大小:SO32-_____SO42-(填“>”“<”或“=”)
(3)CuCl2与氨水反应可形成配合物[Cu(NH3)4]Cl2,1mol该配合物中含有σ键的数目为____________。
(4)四方晶系CuFeS2晶胞结构如图所示。已知:a=b=0.524 nm,c=1.032 nm,NA为阿伏加德罗常数的值,CuFeS2晶体的密度是________gcm3(列出计算式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.甲醛在木材加工、医药等方面有重要用途。甲醇直接脱氢是工业上合成甲醛的新方法,制备过程涉及的主要反应如下:
反应I:CH3OH(g) ![]() HCHO(g)+H2(g) △H1
HCHO(g)+H2(g) △H1
反应II:CH3OH(g)+1/2O2(g) ![]() HCHO(g)+H2O(g) △H2= —156.6kJ/mol
HCHO(g)+H2O(g) △H2= —156.6kJ/mol
反应III:2H2(g)+O2(g) ![]() 2H2O(g) △H3= —483.6kJ/mol
2H2O(g) △H3= —483.6kJ/mol
(1)计算反应I的反应热△H1=_____________。
(2)750K下,在恒容密闭容器中,发生反应CH3OH(g) ![]() HCHO(g)+H2(g),若起始压强为P0,达到平衡转化率为α,则平衡时的总压强P平=___________(用含P0和α的式子表示);当P0=101kPa,测得α=50.0%,计算反应平衡常数Kp=___________kPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,忽略其它反应)。
HCHO(g)+H2(g),若起始压强为P0,达到平衡转化率为α,则平衡时的总压强P平=___________(用含P0和α的式子表示);当P0=101kPa,测得α=50.0%,计算反应平衡常数Kp=___________kPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,忽略其它反应)。
II. CO2既是温室气体,也是重要的化工原料,以CO2为原料可合成多种有机物。
(3)二氧化碳与氢气在催化剂作用下可制取低碳烯烃。在一恒容密闭容器中分别投入1molCO2、3molH2,发生反应:2CO2(g)+6H2(g) ![]() C2H4(g)+4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如图所示。
C2H4(g)+4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如图所示。

①其他条件不变,起始时若按1molCO2、2molH2进行投料,则CO2的转化率将________(填“增大”“ 减小”或“不变”)。
②△H______ (填“>”“<”或“不能确定”)0。
③若测试中体系内无氧气产生,试结合图示推断热稳定性:C2H4_________(填“>” “<”或“不能
确定”)H2O。
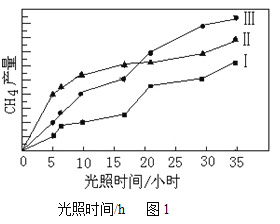
(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(I、Ⅱ,Ⅲ)作用下,CH4产量随光照时间的变化见图1。在15小时内,CH4的平均生成速率I、Ⅱ和Ⅲ从大到小的顺序为______________(填序号)。
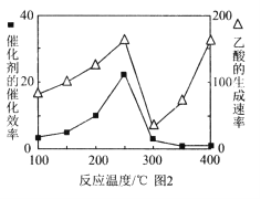
(5)以 TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系见图2。乙酸的生成速率主要取决于温度影响的范围是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种元素,它们原子的核电荷数依次递增且均小于18;A原子核内仅有1个质子;B原子的电子总数与D原子的最外层电子数相等;A原子与B原子的最外层电子数之和与C原子的最外层电子数相等;D原子有两个电子层,最外层电子数是次外层电子数的3倍;E元素的最外层电子数是其电子层数的三分之一。
(1)试推断它们各是什么元素,写出它们的元素符号:
A______、B______、C.______、D______、E______。
(2)写出A分别与B、C、D所形成化合物的化学式:_________、_________、_________。
(3)A、C、D形成的化合物与A、D、E形成的化合物各属于那类物质?__________写出它们相互反应的化学方程式。___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4和CO2反应可以制造价值更高的化学产品.
(1)250℃时,以镍合金为催化剂,向4L容器中通入6molCO2、6molCH4,发生反应:CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g)平衡体系中各组分的浓度为:
2CO(g)+2H2(g)平衡体系中各组分的浓度为:
物质 | CH4 | CO2 | CO | H2 |
平衡浓度mol/L | 0.5 | 0.5 | 2.0 | 2.0 |
①此温度下,该反应的平衡常数K=______注明单位.
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH1kJmol-1
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2kJmol-1
2CO(g)+O2(g)=2CO2(g) ΔH3kJmol-1
反应CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g)的ΔH=______ kJmol-1
2CO(g)+2H2(g)的ΔH=______ kJmol-1
(2)用Cu2Al2O4做催化剂,一定条件下,发生反应:CO2+CH4![]() CH3COOH,请回答:
CH3COOH,请回答:
①温度与催化剂的催化效率和乙酸的生成速率如图250~300℃时,温度升高而乙酸的生成速率降低的原因是______
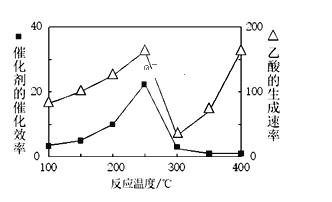
②为提高上述反应CH4的转化率,可采取的措施有______(写2种)
③Cu2Al2O4可溶解在稀硝酸中,被氧化的元素为______,每消耗3molCu2Al2O4时被还原的HNO3为______mol
(3)Li2O、Na2O、MgO均能吸收CO2,
①若寻找吸收CO2的其他物质,下列建议合理的是______
a.可在碱性氧化物中寻找
b.可在具有强氧化性的物质中寻找
c.可在ⅠA、ⅡA族元素的氧化物中寻找
②Li4SiO4可用于吸收、释放CO2,原理是:500℃时, CO2与Li4SiO4接触生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2, Li4SiO4再生,该原理的化学方程式______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2分别通入下列4种溶液中,请回答下列问题:
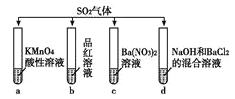
(1)试管a出现溶液褪色的现象,说明SO2具有________性;试管b出现溶液褪色的现象,说明SO2具有________性。
(2)试管d出现白色沉淀,该沉淀能够溶解在稀盐酸中,写出生成该沉淀的离子方程式:________________。
(3)如果将试管d中的NaOH更换为Br2和BaCl2的混合溶液,可以得到一种难溶于强酸的白色沉淀;写出该过程中发生氧化还原反应的离子方程式:________。
(4)试管c中也可得到难溶于强酸的白色沉淀,请你简述该沉淀的生成原因:________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com