
科目:高中化学 来源: 题型:
| ||
| 高温高压 |
| 1 |
| 4 |
| 1 |
| 4 |
| 1 |
| 4 |
| 1 |
| 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 6 |
| 7 |
| 7 |
| 6 |
| 7 |
| 6 |
| 1 |
| 6 |
| 108 |
查看答案和解析>>
科目:高中化学 来源: 题型:
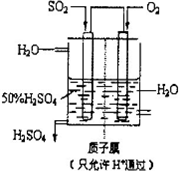 (2010?聊城模拟)利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.
(2010?聊城模拟)利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.| 1 |
| 2 |
| 10 |
| 3 |
c(C
| ||
c(S
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:101网校同步练习 高二化学 山东科学技术出版社 鲁教版 题型:022
在一定温度下,向10 L密闭容器中充入5 mol·SO2和3 mol·O2,反应达到平衡时,混合气体中的SO3的体积分数为46.2%.则SO2的转化率为________,平衡时O2的浓度为________mol·L-1,平衡时容器内的压强为反应前的________倍.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com