
| A、烧杯 | B、玻棒 |
| C、漏斗 | D、胶头滴管 |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:


 与
与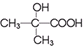 两种有机物,该试剂是
两种有机物,该试剂是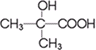 发生缩聚反应生成高分子化合物的结构简式
发生缩聚反应生成高分子化合物的结构简式 ;C、能使Br2的CCl4溶液褪色.
;C、能使Br2的CCl4溶液褪色.查看答案和解析>>
科目:高中化学 来源: 题型:


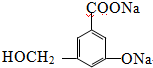
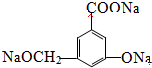 .
.查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、热化学方程式未注明温度和压强时,△H表示标准状况下的数据 |
| B、书写热化学方程式时,各反应物和生成物必须标注其聚集状态 |
| C、同一化学反应,化学计量数不同,△H不同,化学计量数相同而状态不同,△H也不相同 |
| D、化学反应过程所吸收或放出的热量与参加反应的物质的物质的量成正比 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com