
【题目】葡萄糖酸钙是一种可促进骨骼生长的营养物质。葡萄糖酸钙可通过以下反应制得:
C6H12O6(葡萄糖)+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7(葡萄糖酸)+CaCO3→Ca(C6H11O7)2(葡萄糖酸钙)+H2O+CO2
实验流程如下:
C6H12O6溶液![]()
![]()
![]() 滤液
滤液![]() 悬浊液
悬浊液![]()
![]()
![]() Ca(C6H11O7)2
Ca(C6H11O7)2
已知:葡萄糖酸钙微溶于乙醇,可溶于冷水,易溶于热水。则下列说法不正确的是
A.第②步充分反应后CaCO3固体需有剩余,其目的是确保葡萄糖酸完全转化为钙盐
B.第④步加入乙醇的作用是减小葡萄糖酸钙在水中的溶解量,使其结晶析出
C.第⑤步过滤时,发现有固体产品残留在原容器壁上,可加少量热水冲洗再转移至过滤器内
D.可用O2代替Br2,在葡萄糖氧化酶作用下氧化葡萄糖进而制备葡萄糖酸钙
 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】
铜及其化合物在生产生活中有着广泛的应用。请回答下列问题:
(1)铜元素位于元素周期表中第四周期________族,属于元素周期表中________区元素,基态Cu原子有___________种不同能级的电子。
(2)元素铜与镍的第二电离能分别为:ICu=1958 kJ·mol-1、INi=1753 kJ·mol-1, ICu>INi的原因是________________________________________________________。
(3)硫化亚铜和氧化亚铜均为离子晶体,二者比较,熔点较高的是氧化亚铜,原因为_________________________________________。
(4)某含铜化合物的离子结构如图1所示。
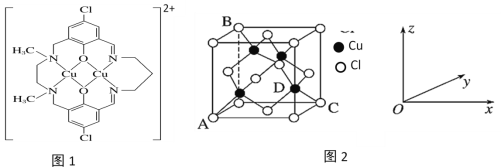
①该离子中存在的作用力有______________(填标号)。
A.离子键 B.共价键 C.配位键 D.氢键 E.范德华力
②该离子中碳原子的杂化类型有____________。
(5)CuCl2和CuCl是铜的两种氯化物。
①图2中表示的是________(填“CuCl2”或“CuCl”)的晶胞。
②原子坐标参数可用来表示晶胞内部各原子的相对位置。图2中各原子坐标参数A为(0,0,0);B为(0,1,1);C为(1,1,0);则D原子的坐标参数为____________。
③已知图2所示晶胞中C、D两原子核间距为298pm,阿伏加德罗常数的值为NA,则该晶体密度为___________________ g·cm-3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成某药物的中间体G的流程如图:

请回答下列问题:
(1)A的名称为___(系统命名法),F的分子式为___。反应⑤的反应类型是___。
(2)C中含氧官能团的名称为__。
(3)已知一定条件下2分子乙酸分子间脱水生成1分子乙酸酐,写出该反应的化学方程式:___。
(4)写出满足下列条件的E的同分异构体的结构简式:___。
①苯环上只有三个取代基;
②核磁共振氢谱图中只有4组吸收峰;
③1mol该物质与足量NaHCO3溶液反应生成2molCO2。
(5)根据已有知识并结合相关信息,写出以C6H5—OOCCH2CH3为原料制备 的合成路线流程图(无机试剂任选)。___。
的合成路线流程图(无机试剂任选)。___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等物质的量的N2、O2、CO2混合气体通过Na2O2后,体积变为原体积的8/9(同温同压),这时混合气体中N2、O2、CO2物质的量之比为
A. 6︰9︰0 B. 3︰3︰2 C. 6︰7︰3 D. 3︰4︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是

A.图1所示,若将开关与a连接,可以实现化学能转化为电能;若将开关与b连接,相当于“外加电流的阴极保护法”
B.冰醋酸加水稀释过程中,溶液的导电能力随着水的体积变化的曲线如图2所示。a、b、c中导电能力最大的是b点,但b点对应醋酸的电离度并非最大
C.图3是室温下H2O2催化分解放出氧气的反应中c(H2O2 )随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小
D.图4为CO(g) + 2H2(g) ![]() CH3OH(g)的能量变化图,由此可知,生成1mol CH3OH(g),至少需要外界提供419kJ 的能量
CH3OH(g)的能量变化图,由此可知,生成1mol CH3OH(g),至少需要外界提供419kJ 的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气因热值高、来源广、产物无污染,常被人们看做一种理想的“绿色能源”,氢气的制取是氢能源利用领域的研究热点。
(1)H2O的热分解可得到H2,高温下水分解体系中主要气体的体积分数与温度的关系如图1所示。图1中曲线A对应的物质是______________。
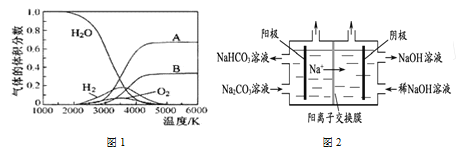
(2)图2为用电解法制备H2,写出阳极的电极反应式:________________。
(3)从可持续发展考虑,太阳能光解水制氢是获取H2的最好途径,但迄今仍然存在诸多问题,如光催化剂大多仅在紫外光区稳定有效,能够在可见光区使用的光催化剂不但催化活性低,而且几乎都存在光腐蚀现象,需使用牺牲剂进行抑制,能量转化效率低等,这些都阻碍了光解水的实际应用,需设计课题进一步研究解决。下列设想符合研究方向的是_________
A 将研究方向专注于紫外光区,无需考虑可见光区
B 研究光腐蚀机理,寻找高稳定性,不产生光腐蚀的制氢材料
C 研制具有特殊结构的新型光催化剂,开发低成本、高性能光催化材料
D 研究新的光解水的催化机制,使利用红外光进行光解水制氢成为可能
(4)以甲烷为原料制取氢气是工业上常用的制氢方法。
已知:CH4(g) + H2O(g) = CO(g)+ 3H2 (g) ΔH= -206.2 kJmol-1
CH4(g) + CO2 (g) = 2CO(g)+ 2H2 (g) ΔH= -247.4 kJmol-1
则CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为:_________
(5)利用废弃的H2S的热分解可生产H2:2H2S(g) ![]() 2H2(g)+S2(g)。现将0.30 mol H2S(g)通入到压强为p的恒压密闭容器中,在不同温度下测得H2S的平衡转化率如图3所示:
2H2(g)+S2(g)。现将0.30 mol H2S(g)通入到压强为p的恒压密闭容器中,在不同温度下测得H2S的平衡转化率如图3所示:
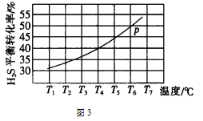
①温度为T4℃时,初始体积为1L,t分钟后,反应达到平衡,该温度下的平衡常数K=________。
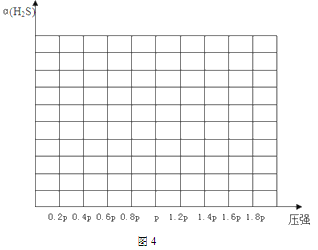
②若保持恒温T℃,将一定量的 H2S(g)通入到恒压密闭容器中,反应一段时间后,压强为p的体系恰好达到平衡,试在图4上画出不同起始压强下H2S转化率的趋势图________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图甲是利用一种微生物将废水中尿素[CO(NH2)2]的化学能直接转化为电能,并生成环境友好物质的装置,同时利用此装置在图乙中的铁上镀铜。下列说法中错误的是 ( )

A.铜电极应与Y电极相连接
B.H+通过质子交换膜由左向右移动
C.当N电极消耗0.25mol气体时,则铁电极增重16g
D.M电极的电极反应式为CO(NH2)2 + H2O -6e- = CO2↑ +N2↑ +6H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“对氨基苯甲酸丁酯”是防晒霜中能吸收紫外线的防晒剂。下列关于“对氨基苯甲酸丁酯”的说法正确的是( )
A. 从有机物分类看,它可属于“氨基酸类”“酯类”“芳香烃类”
B. 它能与盐酸反应,但不能与苛性钠溶液反应
C. 甲酸丁酯基(—COOC4H9)有3种不同结构
D. 它的分子式为C11H15NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用VSEPR模型预测下列分子或离子的立体结构,其中正确的是 ( )
A. H2O与BeCl2为角形(V形) B. CS2与SO2为直线形
C. SO3与CO![]() 为平面三角形 D. BF3与PCl3为三角锥形
为平面三角形 D. BF3与PCl3为三角锥形
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com