
根据物质的组成和性质将下列无机化合物进行了分类.
物质类别 酸 碱 盐 氧化物 氢化物
化学式 ①H2SO4
②HNO3 ③NaOH
④KOH ⑤Na2SO
⑥KNO3 ⑦SO2
⑧Na2O ⑨HCl
⑩NH3
(1)请仔细观察表格中的物质类别,H、O、C、N五种元素中任选两种或三种组成合适的物质,将化学式分别填在表中②、④、⑥、⑩后面的横线上.
(2)⑦和⑧可发生非氧化还原反应 一种盐.该反应的化学方程式为 .
(3)将⑦通入③的溶液中,反应的离子方程式为 .
(4)⑨极易溶于水并电离出氯离子,大多数含氯离子的盐溶于水也能电离出氯离子.检验溶液中氯离子的方法是取 .
考点: 酸、碱、盐、氧化物的概念及其相互联系;化学方程式的书写;氯离子的检验.
分析: (1)电离出的阳离子全部是氢离子的化合物是酸,电离出的阴离子全部是氢氧根离子的化合物是碱,由金属阳离子或铵根离子和酸根离子形成的化合物是盐,由两种元素组成的化合物,其中一种元素是氧元素的为氧化物,由两种元素组成的化合物,其中一种是氢元素的化合物是氢化物;
(2)酸性氧化物和碱性氧化物反应生成盐;
(3)二氧化硫和氢氧化钠溶液反应生成亚硫酸钠和水或亚硫酸氢钠;
(4)氯离子能和硝酸酸化的硝酸银溶液反应生成氯化银白色沉淀.
解答: 解:(1)由K、H、O、C、N五种元素组成的酸、碱、盐、氢化物分别是:HNO3、KOH、KNO3、NH3,
故答案为:HNO3;KOH;KNO3;NH3;
(2)酸性氧化物和碱性氧化物反应生成盐,二氧化硫和氧化钠反应生成亚硫酸钠,反应方程式为:Na2O+SO2=Na2SO3,
故答案为:生成一,Na2O+SO2=Na2SO3;
(3)二氧化硫和氢氧化钠溶液反应生成亚硫酸钠和水或亚硫酸氢钠,离子反应方程式为:SO2+2OH﹣=SO32﹣+H2O或SO2+OH﹣=HSO3﹣,
故答案为:SO2+2OH﹣=SO32﹣+H2O或SO2+OH﹣=HSO3﹣;
(4)氯离子能和硝酸酸化的硝酸银溶液反应生成氯化银白色沉淀,所以其检验方法是:取少量被检测的溶液于试管中,滴入少量稀硝酸,然后再滴入硝酸银溶液,观察是否有白色沉淀生成,如果有白色沉淀生成就证明含有氯离子,否则没有氯离子,
故答案为:取少量被检测的溶液于试管中,滴入少量稀硝酸,然后再滴入硝酸银溶液,观察是否有白色沉淀生成.
点评: 本题考查了基本概念、物质间的反应、离子的检验、离子方程式的书写等知识点,根据定义来确定酸碱盐、难点是离子方程式的书写,要注意电荷守恒、原子守恒,经常考查检验的离子还有硫酸根离子、铁离子、亚铁离子等,注意总结归纳,题目较简单.


 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案科目:高中化学 来源: 题型:
下列离子方程式正确的是()
A. 三氯化铝溶液中加入过量氨水:Al3++3OH﹣═Al(OH)3↓
B. 向含有0.2 mol FeI2的溶液中通入0.25 mol Cl2:8I﹣+2Fe2++5Cl2═10Cl﹣+4I2+2Fe3+
C. K37ClO3与浓盐酸(HCl)在加热时生成Cl2:37ClO3﹣+6HCl═37Cl﹣+3Cl2↑+3H2O
D. 将0.1 mol/L盐酸数滴缓缓滴入0.1 mol/L 25 mL Na2CO3溶液中,并不断搅拌:2H++CO32﹣═CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体V L(标准状况),向反应后的溶液中(存在Cu2+和SO42﹣)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0g,若上述气体为NO和NO2的混合物,且体积比为1:1,则V可能为( )
A. 9.0 L B. 13.5 L C. 15.7 L D. 16.8 L
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)等质量的O2、CH4、H2的物质的量的比值为 .
38g某二价金属氯化物(ACl2)中含有0.8mol Cl﹣,则ACl2的摩尔质量是 ;A的相对原子质量是 ;ACl2的化学式是 .
(3)新制备的氯水显 黄绿 色,说明氯水中有 (填分子式)分子存在.
(4)向氯水中滴加几滴AgNO3溶液,立即有 生成,说明氯水中有 (填离子符号)存在,反应的化学方程式为 氯水光照后颜色变浅,并放出 气体.
查看答案和解析>>
科目:高中化学 来源: 题型:
在元素周期表的短周期中的X和Y两种元素可组成化合物XY3,下列说法正确的是
A.XY3晶体一定是离子晶体
B.若Y的原子序数为m,X的原子序数可能是m±4
C.X和Y可属于同一周期,不可属于两个不同周期
D.X和Y一定不属于同一主族
查看答案和解析>>
科目:高中化学 来源: 题型:
乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸。为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1 mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生。该反应的离子方程式为 。
(2)该小组同学将2.52g草酸晶体(H2C2O4∙2H2O)加入到100 mL 0.2 mol/L的NaOH溶液中充分反应,测得反应后溶液呈酸性(忽略溶液体积变化),则下列关系合理的是 。
A.c(Na+) +c(H+) =c(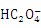 ) +c(OH-) +c(
) +c(OH-) +c(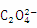 )
)
B.c(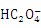 ) +c(
) +c(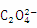 ) =0.2 mol/L
) =0.2 mol/L
C.c(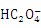 )>c(
)>c(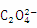 ) >c(H2C2O4)
) >c(H2C2O4)
D.c(Na+)= c(H2C2O4) +c(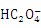 ) +c(
) +c(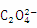 )
)
(3)向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现其溶液的紫红色褪去,有气泡产生,说明乙二酸具有 (填“还原性”、“氧化性”或“酸性”),请写出该反应的离子方程式: 。
(4)乙二醇与乙二酸类似,每个碳上连一个羟基。现以乙烯为原料(其他无机试剂任选),写出由乙烯合成乙二醇的化学方程式。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验的叙述,正确的是( )
A. 溴乙烷加氢氧化钠溶液做催化剂加热水解后,再加AgNO3溶液有浅黄色沉淀生成
B. 实验室用分液漏斗分离苯和水的混合物
C. 可以用酸性高锰酸钾溶液除去乙烷中混有的乙烯
D. 除去苯中的少最苯酚,可以先加浓溴水,充分沉淀后过滤即可
查看答案和解析>>
科目:高中化学 来源: 题型:
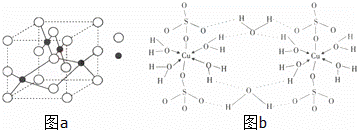
(1)Z与X形成只含一个中心原子的共价化合物,则它的分子式是 ,其分子的立体结构是 .
(2)Y的最高价氧化物晶体类型是 晶体.X的氧化物与Y的最高氧化物中,分子极性较小的是(填分子式) .
(3)如图a是W的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为 .(图中实心球表示W元素)
(4)铜元素和W元素都位于周期表的ds区,胆矾CuSO4•5H2O可写成[Cu(H2O)4]SO4•H2O,其结构示意图如图b,有关它的说法正确的是 (填字母).
A.该胆矾晶体中存在配位键、共价键和离子键
B.该结构中还存在金属键,极性共价键
C.胆矾是分子晶体,分子间存在氢键
D.胆矾中的水在不同温度下会分步失去
(5)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子.已知NF3与NH3的空间构型都是三角锥形,单NF3不易与Cu2+形成配离子,其原因是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com