
| A. | p | B. | Fe | C. | Ca | D. | I |
科目:高中化学 来源: 题型:解答题
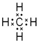
 .
. ,用电子式表示FM2的形成过程
,用电子式表示FM2的形成过程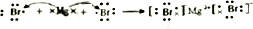 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只含离子键的化合物才是离子晶体 | |
| B. | (NH4)2SO4晶体是含有离子建、共价键和配位键的分子晶体 | |
| C. | 由于I-I中的共价键键比F-F、Cl-Cl、Br-Br都弱,因此在卤素单质中I2的熔点、沸点最低 | |
| D. | 分子晶体中一定不存在离子键,而离子晶体中可能存在共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCHO | B. | CH3COOCH2CH3 | C. | HOOCCOOH | D. | CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
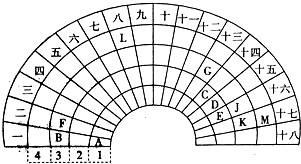
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,H2SO4浓度增加 | |
| B. | 放电时,负极的电极反应式为:Pb+SO42--2e-═PbSO4 | |
| C. | 在充电时,电池中每转移1 mol电子,理论上生成2 mol硫酸 | |
| D. | 在充电时,阴极发生的反应是PbSO4-2e-+2H2O═PbO2+SO42-+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
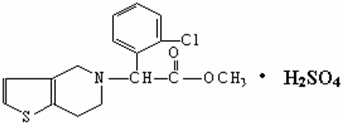
| A. | 该物质的化学式为C16H15ClNO2•H2SO4 | |
| B. | 该物质不溶于水 | |
| C. | 波立维能和氢气反应,每摩最多可消耗3mol氢气 | |
| D. | 它可以与NaOH溶液反应,1mol该物质最多可消耗5molNaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com