
| A、同主族元素含氧酸的酸性随核电荷数的增加而减弱 | ||||
| B、核外电子排布相同的微粒化学性质也相同 | ||||
| C、Cl-、S2-、Ca2+、K+半径逐渐减小 | ||||
D、
|


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:
| 实验目的 | 操作 | |
| A | 证明CH2=CHCH2OH中含有碳碳双键 | 滴入溴水 |
| B | 欲证明浓硫酸有脱水性和强氧化性 | 将浓硫酸滴到蔗糖上 |
| C | 证明FeCl2溶液中含有Fe2+ | 加入酸性KMnO4溶液 |
| D | 比较确定铜和镁的金属活动性强弱 | 用石墨作电极电解Mg(NO3)2、Cu(NO3)2的混合液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、容量瓶中原有少量蒸馏水 |
| B、溶液从烧杯转移到容量瓶中后没有洗涤烧杯和玻璃棒 |
| C、定容时观察液面俯视 |
| D、定容时平视液面 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2-丁烯不存在顺反异构体 |
| B、已知丙烷的二氯代物有四种异构体,则其六氯代物的异构体数目为六种 |
C、菲的结构简式为 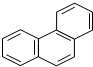 ,它与硝酸反应,可生成4种一硝基取代物 ,它与硝酸反应,可生成4种一硝基取代物 |
| D、乙醛的核磁共振氢谱中有二个峰,峰面积之比是1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、集气瓶中气体的黄绿色逐渐变浅 |
| B、集气瓶内壁上有油状液滴附着 |
| C、集气瓶底部出现黑色颗粒 |
| D、取下玻璃片,可能会看到白雾 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 简单实验方案 | 预测的实验现象 | 结论 |
| 假设 | ||
| 假设 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com