
已知短周期元素的离子.aA2+、bB+、cC3﹣、dD﹣都具有相同的电子层结构,则下列叙述正确的是( )
|
| A. | 原子半径:A>B>C>D | B. | 原子序数:d>c>b>a |
|
| C. | 离子半径:C>D>B>A | D. | 单质的还原性:A>B>D>C |
考点:
位置结构性质的相互关系应用.
专题:
元素周期律与元素周期表专题.
分析:
aA2+、bB+、cC3﹣、dD﹣都具有相同电子层结构,则A、B在下一周期,为金属元素,且原子序数a>b,C、D在上一周期,为非金属元素,且原子序数d>c,以此来解答.
解答:
解:aA2+、bB+、cC3﹣、dD﹣都具有相同电子层结构,则A、B在下一周期,为金属元素,且原子序数a>b,C、D在上一周期,为非金属元素,且原子序数d>c,
A.电子层越多,半径越大,同周期原子序数越大,半径越小,则原子半径为B>A>C>D,故A错误;
B.由电子层数越多的原子序数越大,同周期从左向右原子序数在增大,所以原子序数为a>b>d>c,故B错误;
C.具有相同电子排布的离子,原子序数大的离子半径小,原子序数为A>B>D>C,则离子半径为C3﹣>D﹣>B+>A2+,故C正确;
D.由同周期从左向右元素的金属性在减弱,非金属性在增强,金属性为B>A>C>D,则单质的还原性B>A>C>D,故D错误;
故选C.
点评:
本题考查原子结构与元素周期律的关系,明确离子具有相同的电子排布推出元素的位置是解答本题的关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
保护环境是每一个公民的责任,下列做法有利于保护环境的是( )
①推广使用无磷洗涤剂 ②城市生活垃圾分类处理 ③推广使用一次性木质筷子 ④推广使用清洁能源 ⑤过量使用化肥、农药 ⑥推广使用无氟冰箱.
A. ①②④⑤ B. ②③④⑥ C. ①②④⑥ D. ③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质属于同系物的是( )
A. CH3CH2CH2OH与CH3OH B. 
C. 乙酸与HCOOCH3 D. CH3CH2Cl与CH3CH2CH2Br
查看答案和解析>>
科目:高中化学 来源: 题型:
某种“光敏性高分子”材料在荧光屏及大规模集成电路中应用广泛.其结构可表示为:
对该“光敏性高分子”叙述正确的是( )
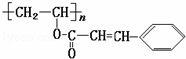
A. 化学式为(C11H11O2)n
B. 它能发生加成反应,不能发生水解反应
C. 它可以和FeCl3溶液发生显色反应
D. 1mol该分子最多能和4nmolH2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表示物质结构的化学用语或模型图正确的是( )
|
| A. | H2O2的电子式: | B. | CS2的比例模型: |
|
| C. | 14C的原子结构示意图: | D. | CCl4的结构式: |
查看答案和解析>>
科目:高中化学 来源: 题型:
五种短周期元素的某些性质如表所示(其中Z、M、W为同周期元素).下列说法不正确的是( )
| 元素代号 | Y | X | W | M | Z |
| 原子半径(×10﹣12m) | 64 | 73 | 78 | 96 | 113 |
| 主要化合价 | ﹣1 | +5、﹣3 | +7、﹣1 | +4、﹣4 | +3 |
|
| A. | 由M与W形成的化合物是含有极性键的极性分子 |
|
| B. | X与M之间形成的化合物,其晶体是原子晶体 |
|
| C. | 由M元素形成的晶体,是太阳能光伏发电的主要材料,工业上制取M单质,可通过置换反应原理来生产 |
|
| D. | Y与Z元素形成的[ZY6]3﹣,离子中存在配位键,该离子构型呈正八面体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关晶体的叙述中,正确的是( )
|
| A. | 在Si晶体中,Si原子与Si﹣Si键之比为1:4 |
|
| B. | 在NaCl晶体中,每个Na+周围距离最近的Na+有6个 |
|
| C. | 在CsCl晶体中,与每个Cs+紧邻的Cs+有8个 |
|
| D. | 在面心立方堆积的金属晶体中,每个金属原子周围紧邻的有12个金属原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某元素X的气态氢化物的化学式为H2X,则X的最高价氧化物的水化物的化学式为( )
|
| A. | H2XO3 | B. | HXO3 | C. | H3XO4 | D. | H2XO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com