
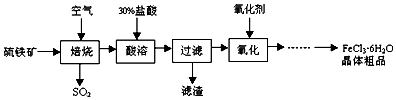
| A. | “焙烧”反应中,氧化产物是SO2,还原产物是Fe3O4 | |
| B. | “酸溶”时的酸可以用稀硫酸代替 | |
| C. | “过滤“后的滤液中Fe3+和Fe2+的浓度比为2:1 | |
| D. | “氧化”时的氧化剂只能选取Cl2 |
分析 由以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体的流程可知,在焙烧时FeS2与氧气反应生成四氧化三铁和二氧化硫,然后四氧化三铁溶于盐酸生成氯化铁,过滤后滤液中加氧化剂氯气(或氯水等),除去混有的亚铁离子,最后结晶制备晶体,以此来解答.
解答 解:A.焙烧硫铁矿石过程中铁元素转化成了Fe3O4,发生3FeS2+8O2$\frac{\underline{\;高温\;}}{\;}$Fe3O4+6SO2,S、Fe元素的失去电子被氧化,则氧化产物是SO2,Fe3O4、故A错误;
B.“酸溶”中反应的离子方程式是Fe3O4+8H+=2Fe3++Fe2++4H2O,若用硫酸,最终为硫酸铁,不能制备氯化铁晶体,故B错误;
C.“过滤”后滤液中金属阳离子有Fe3+、Fe2+,由Fe3O4+8H+=2Fe3++Fe2++4H2O可知滤液中Fe3+和Fe2+的浓度比为2:1,故C正确;
D.氧化的目的是除去亚铁离子,且不引入新杂质,则“氧化”中使用的氧化剂最好是Cl2(或H2O2等),故D错误;
故选C.
点评 本题考查制备实验方案的设计,为高频考点,把握制备流程中的反应、混合物分离方法为解答的关键,侧重分析与实验能力的考查,注意氧化还原反应的分析,题目难度不大.


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:实验题
| 操作步骤 | 实验现象 | 结论 |
| 取少量I中溶液于试管甲中,滴加品红溶液和盐酸 | 品红始终不褪色 | ①无SO2(或HSO3-或SO32-)生成 |
| 另取少量I中溶液于试管乙中,加入Ba(OH)2溶液,振荡 | ②白色沉淀 | 有SO42-生成 |
| ③继续在试管乙中滴加Ba(OH)2溶液至过量,静置,取上层清液于试管丙内 加入足量稀硝酸酸化的硝酸银溶液 | 有白色沉淀生成 | 有Cl-生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用CO2合成聚碳酸酯可降解塑料,实现“碳”的循环利用 | |
| B. | 氯水中加入稀硫酸,可增强氯水的漂白性 | |
| C. | 用蘸有浓氨水的玻璃棒检验输送氯气的管道是否漏气 | |
| D. | 加工后具有吸水性的植物纤维可用作食品干燥剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石墨 | B. | 二氧化锰 | C. | 汞 | D. | 锌 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com