
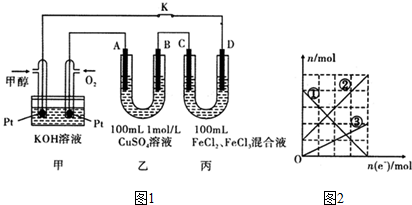
分析 (1)甲醇燃料电池是原电池反应,甲醇在负极失电子发生氧化反应,注意电解质溶液是碱性溶液;
(2)利用电子守恒,计算3.2g铜反应转移电子物质的量,再据100mL1mol/L的硫酸铜溶液中含有溶质的物质的量和电解后生成硫酸的物质的量计算离子浓度;
(3)A为阳极,始终是氢氧根离子放电,B为阴极,开始是铜离子放电,后来是氢离子放电,据电子守恒计算产生气体体积;
(4)C电极为阳极,D电极为阴极,根据丙图可知溶液中有三种金属阳离子,而根据丙的成分可知溶液中只有两种金属阳离子,说明在电解过程中还有Cu2+生成,因此C电极是Cu做阳极,D电极是石墨做阴极,根据转移电子的物质的量和金属阳离子的物质的量的变化确定曲线对应的离子,结合转移电子的物质的量计算.
解答 解:(1)甲醇燃料电池是原电池反应,甲醇在负极失电子发生氧化反应,电极反应为:CH3OH-6e-+8OH-=CO32-+6H2O,
故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;
(2)100mL1mol/L的硫酸铜溶液中含有铜离子0.1mo,硫酸根离子0.1mol,当电解硫酸铜溶液时,阴极反应式为:Cu2++2e-=Cu,阳极反应式为:4OH--4e-=2H2O+O2↑,乙中生成铜3.2g即0.05mol溶,转移电子0.1mol,A极反应掉氢氧根离子0.1mol,生成氢离子0.1mol,剩余铜离子0.05mol,硫酸根离子物质的量没有变化,溶液中还存在水的电离平衡,所以离子浓度大小顺序为:c(H+)>c(SO42-)>c(Cu2+)>c(OH-),
故答案为:c(H+)>c(SO42-)>c(Cu2+)>c(OH-);
(3)工作一段时间后,断开K,此时A、B两极上产生的气体体积相同,分析电极反应,B为阴极,溶液中铜离子析出,氢离子得到电子生成氢气,设生成气体物质的量为X,溶液中铜离子物质的量为0.1mol,电极反应为:
Cu2++2e-=Cu,2H++2e-=H2↑;
0.1mol 0.2mol 2x x
A电极为阳极,溶液中的氢氧根离子失电子生成氧气,电极反应为:
4OH--4e-=2H2O+O2↑;
4x x
得到0.2+2x=4x
x=0.1mol
乙中A极析出的气体是氧气物质的量为0.1mol,在标准状况下的体积为2.24L;
故答案为:2.24L;
(4)根据转移电子的物质的量和金属阳离子的物质的量的变化,可知,铜离子从无增多,铁离子物质的量减小,亚铁离子增加,①为Fe3+,②为Fe2+,③为Cu2+,
依据(3)计算得到电子转移为0.2mol,当电子转移为0.2mol时,丙中阳极电极反应Cu-2e-=Cu2+,生成Cu2+物质的量为0.1mol,图象分析每个单位为0.05mol,阴极电极反应Fe3++e-=Fe2+,溶液中有Fe3+ 0.2mol,Fe2+ 0.3mol,Cu2+为0.1mol,所以需要加入NaOH溶液1.4mol,所以NaOH溶液等体积为1.4mol5mol/L=0.28L=280ml,
故答案为:Fe2+;280.
点评 本题综合性较大,题目涉及燃料电池、电解原理的应用、离子浓度大小比较、电极反应式书写以及据电极反应式的计算,题目难度中等,注意把握原电池和电解质中电极方程式的书写以及电子守恒在计算中的应用.


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 25°C时,1L pH=1的硫酸溶液中,含有H+的数目为0.2NA | |
| B. | 2mol SO2与足量氧气在适当的条件下反应生成SO3,转移的电子数为4NA | |
| C. | 含1mol Cl-的NH4Cl溶液中加入适量氨水使溶液呈中性,此时溶液中NH4+数为NA | |
| D. | 2mL 0.5mol/L硅酸钠溶液中滴入过量盐酸制备硅酸胶体,所得胶粒数目为0.001NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)已知1molSO2(g)生成1molSO3(g)的能量变化如图所示,回答下列问题:
(1)已知1molSO2(g)生成1molSO3(g)的能量变化如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
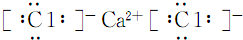 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡向正反应方向移动 | B. | C的体积分数降低 | ||
| C. | B的转化率降低 | D. | a+b<c+d |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com