
| A. | 锂 | B. | 钠 | C. | 氟 | D. | 氯 |
 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:解答题
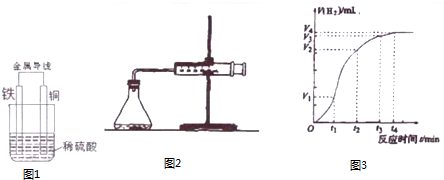
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
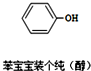 近期微博热传的“苯宝宝表情包”是一系列苯的衍生物配以相应的文字形成的(如图所示).则关于有机物的说法正确的是( )
近期微博热传的“苯宝宝表情包”是一系列苯的衍生物配以相应的文字形成的(如图所示).则关于有机物的说法正确的是( )| A. | 碳原子采用sp3杂化 | |
| B. | 氧原子采用sp2杂化 | |
| C. | 该有机物属于醇类 | |
| D. | 该分子中的13个原子有可能处于同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中只存在离子键 | |
| B. | 任何物质中都存在化学键 | |
| C. | 金属氧化物一定是碱性氧化物,非金属氧化物可能不是酸性氧化物 | |
| D. | 仅由非金属元素组成的化合物中可能含离子键,但仅由两个非金属原子构成的微粒不含离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “另一种反应物”一定具有还原性 | B. | “另一种反应物”一定只具有氧化性 | ||
| C. | 2CuH+3Cl2 $\frac{\underline{\;点燃\;}}{\;}$2CuCl2+2HCl | D. | CuH既可作氧化剂也可作还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的原子序数一定大于Y | |
| B. | 第一电离能Y一定小于X | |
| C. | X和Y在形成化合物时,X显负价、Y显正价 | |
| D. | 气态氢化物的稳定性:HmX强于HnY |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
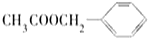 )广泛存在于可可、咖啡、草莓等物质中,可用作食物和日化用品的香精.已知:X的产量可以用来衡量一个国家的石油化工发展水平,工业上可用X和甲苯人工合成乙酸苯甲酯.其合成路线如下:
)广泛存在于可可、咖啡、草莓等物质中,可用作食物和日化用品的香精.已知:X的产量可以用来衡量一个国家的石油化工发展水平,工业上可用X和甲苯人工合成乙酸苯甲酯.其合成路线如下: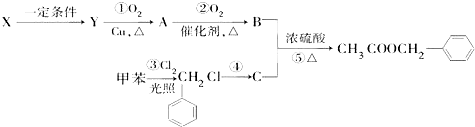
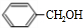 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$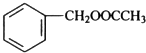 +H2O.
+H2O.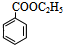 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com