
分析 碳酸钙生成生石灰需要吸收热量,碳燃烧过程是放热反应,1t石灰石分解需要的热量由碳燃烧放出的热量提供,依据热化学方程式计算得到.
解答 解:1t 碳酸钙生成生石灰,依据热化学方程式计算可知吸收热量为:1×106g×$\frac{178.2kJ}{100g}$=1.782×106kJ;
设理论上需焦炭x千克
C(s)+O2(g)=CO2(g);△H2=-393.5kJ/mol
12g 393.5kJ
x×1000 1.782×106kJ
x=$\frac{12g×1.782×1{0}^{6}kJ}{393.5kJ×1000}$≈54.34kg,
答:1t 碳酸钙生成生石灰理论上需含焦炭54.34千克.
点评 本题考查了热化学方程式的计算应用,注意碳酸钙分解需要的热量等于碳燃烧放出的热量,热化学方程式的计算是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 水、浓H2SO4、洗气 | B. | 饱和NaHCO3溶液、浓H2SO4、洗气 | ||
| C. | 饱和NaCl溶液、浓H2SO4、洗气 | D. | NaOH溶液、浓H2SO4、洗气 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
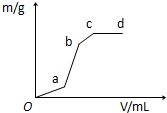 向用盐酸酸化的MgSO4溶液中加入Ba(OH)2溶液,产生的沉淀质量m与加入的体积V之间的关系,关于图曲线的推测正确的是( )
向用盐酸酸化的MgSO4溶液中加入Ba(OH)2溶液,产生的沉淀质量m与加入的体积V之间的关系,关于图曲线的推测正确的是( )| A. | ab段产生的沉淀为硫酸钡 | |
| B. | ab产生段的沉淀为氢氧化镁 | |
| C. | bc段产生的沉淀为氢氧化镁 | |
| D. | bc段产生的沉淀为硫酸钡和氢氧化镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤⑥ | B. | ④⑤⑥ | C. | ①②⑤ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu与Cu20的物质的量之比为2:1 | |
| B. | 硝酸的物质的量浓度为2.4mol/L | |
| C. | 产生的NO在标准状况下的体枳为4.48L | |
| D. | Cu、Cu20与硝酸反应后剩余HN03为lmol |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 在图中的物质均为中学化学中常见的物质,其中甲、乙为单质,其余均为化合物,B为常见液态化合物,A为淡黄色固体,F、G所含元素相同且均为氯化物,G遇KSCN溶液呈红色.请问答下列问题:
在图中的物质均为中学化学中常见的物质,其中甲、乙为单质,其余均为化合物,B为常见液态化合物,A为淡黄色固体,F、G所含元素相同且均为氯化物,G遇KSCN溶液呈红色.请问答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
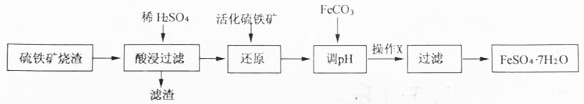
| Fe3+ | Al3+ | Fe2+ | |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)=1×10-7 mol/L | B. | c(OH-)=1×10-7mol/L | ||
| C. | c(H+)=c(OH-) | D. | pH=7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com