
����Ŀ����ú����ȼú�糧�ų�����Ҫ�������ҹ���糧��ú�ҵ���Ҫ���������ΪSiO2��Al2O3��CaO�ȣ�һ�����÷�ú����ȡ�������Ĺ����������£�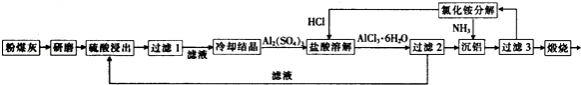
��1����ú����ĥ��Ŀ���� ��
��2����1�ι���ʱ��������Ҫ�ɷ������ѧʽ����ͬ���� �� ��3�ι���ʱ�����ijɷ���
��3����104���������ȡʱ�����Ľ�ȡ����ʱ��Ĺ�ϵ��ͼ1�����˵Ľ�ȡʱ��Ϊh�����Ľ�ȡ���� ![]() �Ĺ�ϵ��ͼ2��ʾ���ӽ�ȡ�ʽǶȿ��ǣ��������ܼ�NH4F��KF��NH4F��KF�Ļ�����
�Ĺ�ϵ��ͼ2��ʾ���ӽ�ȡ�ʽǶȿ��ǣ��������ܼ�NH4F��KF��NH4F��KF�Ļ����� ![]() ��ͬʱ����ȡ����ߵ������ѧʽ�����ú����Ļ��������������ܼ���ȱ��������һ������
��ͬʱ����ȡ����ߵ������ѧʽ�����ú����Ļ��������������ܼ���ȱ��������һ������ 
��4��������ѭ��ʹ�õ��������� �� ���ѧʽ��
��5���������ܽ����������壬��ͨ��HCl���壬����A1C136H20���ù����ܹ�������ԭ����
��6���÷�ú����ȡ�������������Ҫ������ ��
���𰸡�
��1������Ӧ��ĽӴ��������߽�ȡ���ʺͽ�����
��2��SiO2��CaSO4��Al��OH��3
��3��2��NH4F�����������л������Ⱦ������HF��NH3��
��4��H2SO4��NH4Cl
��5��ͨ���Ȼ���ʹA1C13?6H20�ﵽ���ͣ���������������
��6��ʹ����������Դ������
���������⣺��ú�ҵ���Ҫ���������ΪSiO2��Al2O3��CaO�ȣ�����������ҺʹAl2O3�ܽ⣬CaOͨ����Ӧ����CaSO4 �� CaSO4�ܣ���CaSO4��SiO2һ���Ϊ���������˺���Һ��ȴ�ᾧ��Al2��SO4��3 �� �������ܽ�Al2��SO4��3 �� ��ͨ���Ȼ����AlCl36H2O�����������Һ�����˵�������Һ������ѭ�����ã�AlCl36H2O�����ܽ����Ȼ�����Һ��ͨ�백�������������������Ȼ����Һ���Ȼ����Һ����ѭ�����ã����������������ȷֽ�����Al2O3 �� ��1����ú����ĥ��Ŀ��������Ӧ��ĽӴ��������߽�ȡ���ʺͽ����ʣ����Դ��ǣ�����Ӧ��ĽӴ��������߽�ȡ���ʺͽ����ʣ���2��ͨ������ķ�����֪����1�ι���ʱ��������Ҫ�ɷ���SiO2�� CaSO4 �� ��3�ι���ʱ�����ijɷ���Al��OH��3 ��
���Դ��ǣ�SiO2�� CaSO4��Al��OH��3����3������ͼ1��֪��2hʱ���Ľ����ʴﵽ���ֵ���������˵Ľ�ȡʱ��Ϊ2h������ͼ2��֪���� ![]() ��ͬʱ��NH4F���ܼ������Ľ�������ߣ��ú����Ļ��������������ܼ���ȱ�������������л������Ⱦ������HF��NH3�ȣ����Դ��ǣ�2�� NH4F�����������л������Ⱦ������HF��NH3�ȣ���4����������ķ�����֪��������ѭ��ʹ�õ�������H2SO4��NH4Cl��
��ͬʱ��NH4F���ܼ������Ľ�������ߣ��ú����Ļ��������������ܼ���ȱ�������������л������Ⱦ������HF��NH3�ȣ����Դ��ǣ�2�� NH4F�����������л������Ⱦ������HF��NH3�ȣ���4����������ķ�����֪��������ѭ��ʹ�õ�������H2SO4��NH4Cl��
���Դ��ǣ�H2SO4��NH4Cl����5���������ܽ����������壬��ͨ��HCl���壬����A1C136H20���ù����ܹ�������ԭ����ͨ���Ȼ���ʹA1C136H20�ﵽ���ͣ��������������ͣ�����A1C136H20������
���Դ��ǣ�ͨ���Ȼ���ʹA1C136H20�ﵽ���ͣ��������������ͣ� ��6���÷�ú����ȡ�������������Ҫ��������ʹ����������Դ�����ã�
���Դ��ǣ�ʹ����������Դ�����ã�


 ���Ӣ��������ϵ�д�
���Ӣ��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��
��C ��s��+ ![]() O2��g���TCO ��g����H=��110.5kJmol ��1
O2��g���TCO ��g����H=��110.5kJmol ��1
��C ��s��+O2 ��g���TCO2 ��g����H=��393.51kJmol ��1
��Ӧ��C ��s��+CO2��g���T2CO ��g�� �ġ�HΪ�� ��
A.��283.01 kJmol ��1
B.+504.00 kJmol ��1
C.+283.01 kJmol ��1
D.+172.51 kJmol ��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ��ش��������⣮
��1��AԪ�صĸ�һ�����ӵĵ��Ӳ�ṹ�����ͬ������Ԫ�����ڱ��е�λ��Ϊ
��2��BԪ�ػ�̬ԭ�ӵ��������2��δ�ɶԵ��ӣ��������2�����ӣ���Ԫ������Ϊ
��3��DԪ�ػ�̬ԭ�ӵ�M��ȫ������N��û�гɶԵ��ӣ�ֻ��һ��δ�ɶԵ��ӣ�D�����������Ų�ʽΪ
��4��XԪ�ص�ԭ�����������Ų�ʽΪnsnnpn+1 �� YԪ�ص�ijͬλ��ԭ�������ӣ�X��Y�γɵ��������ĽṹʽΪ
��5��MԪ�ص����������ӵ�3d�ܼ�Ϊ�������M��̬ԭ�ӵĵ����Ų�ʽΪ
��6�������N��ʧȥ���ӵĵ����ܣ�
I1 | I2 | I3 | I4 | I5 | I6 | |
In | 578 | 1817 | 2745 | 11578 | 14831 | 18378 |
��Ԫ��N�ij�����̬�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£����и���������ָ����Һ��һ���ܴ���������ǣ� ��
A.ʹ���ȳʺ�ɫ����Һ�У�K+��AlO2����NO3����CO32��
B.c��ClO����=1.0 mol?L��1��Һ��Na+��SO32����S2����Cl��
C.ˮ���������c��H+��=1��10��12����Һ��K+��NH4+��SO42����Fe3+
D.![]() =0.1 mol?L��1����Һ��Na+��AlO2����CO32����NO3��
=0.1 mol?L��1����Һ��Na+��AlO2����CO32����NO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����FeSO3��Һ�к���������SnSO4 �� Ϊ�õ������������������壨FeSO4xH2O����������Һ��ͨ��H2S���������ͣ�Ȼ���������ữ��pH=2�����˺�������Һ����Ũ������ȴ�ᾧ������ϴ�ӣ��õ������������壮�������ϣ��õ�������ʵ��й��������±���
25�� | pH | 25�� | pH |
����H2S��Һ | 3.9 | FeS��ʼ���� | 3.0 |
SnS������ȫ | 1.6 | FeS������ȫ | 5.5 |
��1��������������������FeSO4��Һʱ�������������� ��
��2��Ϊ�����Ƶõ����������������Ƿ���Fe3+ �� ��ѡ�õ��Լ�Ϊ ��
A.KSCN��Һ
B.ϡ����
C.���۩�KI��Һ
D.KMnO4��Һ
��3��ͨ��H2S���������͵�Ŀ�������������ữ��pH=2��Ŀ���� ��
��4��Ϊ�о���������������ȷֽ⣬ij��ȤС��ͬѧ��ȡag��������������Ʒ����ͼ1װ�ý��и��¼��ȣ�ʹ����ȫ�ֽ⣨�������������ڸ��������»طֽ�Ϊ���ֻ������һ�ֵ��ʣ��õ�����ʹ�����ǵ�ľ����ȼ���������ò������̽������ͨ������װ��B���������x��ֵ��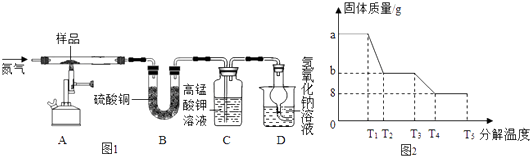
��װ��B����ˮ����ͭ��ĩ��������������12.6g��˵����������ˮ��װ��C�и��������Һ��ɫ��˵�������к��� ��
��ʵ����Ҫ����ͨ�뵪������������x�����ƫ�ڡ�����ƫ�ڡ����䡱����
����������������ȫ�ֽ��װ��A�й���ʺ���ɫ�������������ϡ�����У�����ȫ���ܽ⣬�û�ɫ��Һ��
��ij�о�������SDTQ600�ȷ����Ƕ�����������������ȷֽ⣬���������ݣ����ƳɵĹ���������ֽ��¶ȵĹ�ϵͼ��ͼ2������ͼ���й����ݣ��ɼ����xΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ñ�������Һ�ζ�����Ũ�ȵļ���Һʱ�����в����л��������ҺŨ�ȵIJⶨֵƫ����ǣ� ��
A.��ƿ����Һ�ڵζ������н���
B.��ƿ������ˮ��ϴ��δ�ô���Һ��ϴ
C.ָʾ����ɫ15 s���ָֻ�Ϊԭ������ɫ��ֹͣ�ζ�
D.�ζ���װҺ����첿λ�����ݣ��ζ���������ʧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������顢����Ұ����Ѿ����������ٴ������˸�Ⱦ�����У����ٴ��о������������Ƚ���Ұ��ĸ�����С��
��1����������ͨ������ת�����ɽ���Ұ���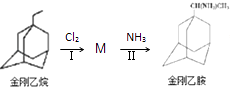
�ٽ������ķ���ʽΪ ��
�ڷ�Ӧ��ķ�Ӧ����Ϊ �� ��Ӧ�����һ����Ϊ ��
��2��������黹��ͨ����ͼ����ת�����ɸ߷��ӻ�����á�R������ʾ 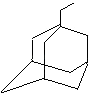 �����������ʾΪR��CH2CH3����
�����������ʾΪR��CH2CH3���� ![]()
��֪��E������������C=O˫���������ܷ���������Ӧ����״���£�1molF������������ȫ��Ӧ������22.4L���壬��������NaHCO3��Һ��ȫ��ӦҲ������22.4L���壮
������1Ϊ ��
������2Ϊ �� д��C��D�Ļ�ѧ����ʽ�� ��
��E�����й����ŵ�����Ϊ �� G�Ľṹ��ʽΪ ��
����������������F��ͬ���칹��ֻ��һ�֣���ṹ��ʽΪ ��
a�����ڷ����廯����
b���˴Ź�������ͼ��ֻ���������շ壬�ҷ����֮��Ϊ1��1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о���ѧϰС�������һ��ʵ�飬��֤Ԫ�������ɣ�
��1����ͬѧ��a��b��c��ֻ�ձ���ֱ����50mLˮ���ٷֱ�μӼ��η�̪��Һ�����μ����С�����ﮡ��ơ��ؿ飬�۲����ټ�ͬѧ���ʵ���Ŀ������
�ڷ�Ӧ����ҵ��ձ���������ĸ����
��д��b�ձ������Ӧ�����ӷ���ʽ ��
��2����ͬѧ���ʵ����֤��Ԫ�صķǽ�����Խǿ������ۺ���������Ծ�Խǿ�������������ͼװ����֤C��N��Si����Ԫ�صķǽ�����ǿ����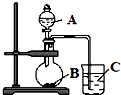
��д����ѡ�����ʵĻ�ѧʽ��A�� B��C��
��д��Բ����ƿ�з�����Ӧ�����ӷ���ʽ��
��д���ձ��з�����Ӧ�����ӷ���ʽ��
��̼������������Ԫ�صķǽ�������ǿ����˳��Ϊ��
��3����ͬѧ��Ϊ��ͬѧ��Ƶ�ʵ�鲻���Ͻ���Ӧ����B��C֮������һ��ϴ��װ�ã�������Ӧʢ�������Լ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���д������( )
A.ͨ�����Ǻ͵��۶����Ի�ԭ��
B.�ô�����ľ���һ���������ܷⱣ�棬ʱ��Խ��Խ�㴼
C.��ά�ء����ǡ������Ǻ�֬����һ�������¶��ɷ���ˮ�ⷴӦ
D.��ά�ط������������ǵ�Ԫ��ɵģ����Ա��ֳ�һЩ��Ԫ��������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com