
【题目】下列电离方程式书写正确的是( )
A.把CaCl2放入水中:CaCl2===Cu2++Cl2-
B.把NaHSO4放入水中:NaHSO4===Na++H++SO![]()
C.把Ba(OH)2放入水中:Ba(OH)2=== Ba 2++(OH)2-
D.把H2SO4放入水中:H2SO4=== H2++SO42-
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
【题目】下列化学反应的离子方程式中正确的是( )
A. 盐酸与碳酸钡反应:CO32-+2H+ = CO2↑+H2O
B. 硫酸铜溶液中滴加氢氧化钡溶液:Ba2++SO42-= BaSO4↓
C. 澄清石灰水与少量小苏打溶液混合:Ca2+ + OH-+ HCO3-= CaCO3↓ + H2O
D. 向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2气体是安全、无毒的绿色消毒剂和保鲜剂,使用中不产生致癌物及二次污染物。某化学兴趣小组通过下图对其吸收、释放进行研究,请回答以下问题:

(1)用KClO3与Na2SO3在H2SO4酸化时制取ClO2,该反应的离子方程式为______。
(2)如图A中盛放有Na2CO3-H2O2混合溶液,常用于ClO2的吸收稳定剂。已知ClO2被稳定剂吸收生成NaClO2,若C中淀粉KI-H2SO4溶液变蓝,_____(填“能”或“不能”) 说明在仪器A中ClO2被完全吸收。
(3)已知ClO2的消毒能力是等物质的量Cl2的2.5倍,则ClO2在将含氰废液中的CN-氧化成CO2和N2的反应中,氧化剂和还原剂的物质的量之比为______。
(4)由B向A中滴加稀盐酸即可释放出ClO2,此时C的作用是_____。已知ClO2能被多种稳定剂所吸收,若将ClO2用于果蔬保鲜,图中吸收效果较好的稳定剂是___(填 “Ⅰ”或“Ⅱ”),原因是______。

(5)ClO2的“有效氯”可通过标定反应后溶液中的残氯[c(Cl-)]来测定。在分析化学中以K2CrO4为指示剂,用AgNO3标准溶液滴定溶液中的Cl-,当出现砖红色沉淀时,即指示达滴定终点。若保证溶液中c(Cl-)降为1.0×10-5 mol/L,则此时溶液中c(CrO42-)应不超过______mol/L。[Ksp(AgCl)=2.0×10-10,Ksp(Ag2CrO4)=2.0×10-12]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂除去杂质,从而得到纯净的NaNO3晶体,相应的实验流程如图所示。
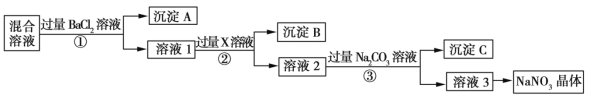
请回答下列问题:
(1)写出实验流程中下列物质的化学式:试剂X___,沉淀A____。
(2)上述实验流程中①②③步均要进行的实验操作是___(填操作名称)。
(3)上述实验流程中加入过量Na2CO3溶液的目的是______________________________。
(4)按此实验方案得到的溶液3中肯定含有______(填化学式)杂质。为了解决这个问题,可以向溶液3中加入适量的___(填化学式),之后若要获得NaNO3晶体,需进行的实验操作是____(填操作名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是 ( )
A.常温常压下,22.4 L CCl4、CO2含有的分子数为1NA
B.常温常压下,1.06 g Na2CO3含有的Na+离子数为0.02NA
C.通常状况下,NA个CO2分子占有的体积约为22.4 L
D.物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl-个数为1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 60gSiO2和12g金刚石中各含有4NA个Si-O键和4NA个C-C键
B. H2O(g)通过足量Na2O2(s)充分反应,固体增重bg时,反应中转移的电子数为bNA/2
C. 1L0.2mo1/ LNaHCO3溶液中含HCO3-和CO32-的离子数之和为0.2NA
D. 足量的Mg与稀H2SO4完全反应,生成2.24LH2时,转移的电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是( )
A. 电镀时,待镀的金属制品作阳极
B. 用惰性电极电解CuSO4溶液,溶液pH增大
C. 氢氧燃料电池(酸性电解质)中,正极反应为O2+4H++4e﹣=2H2O
D. 镀锌铁皮比镀锡铁皮耐腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水氯化锌是有机合成中重要催化剂,无水氯化锌为白色粉末,易潮解,沸点为732℃。久置市售氯化锌常含Zn(OH)Cl,影响催化效果。实验室用HC1气体“置换”除水、升华氯化锌相结合的方法提纯市售氯化锌。
(1)选用下图所示的装置(可以重复选用)进行实验,装置接口依次连接的合理顺序为:a→___________。

(2)装置A盛氯化钠固体的仪器名称是___________,装置C中试剂是___________。
(3)实验开始时,通入HC1和N2,将管式炉I,Ⅱ升温至150℃,装置D中发生的化学反应方程式为___________;此时通入N2的目的是______________________;
(4)反应一段时间后保持管式炉I、Ⅱ温度为350℃,保证将水除尽,再______________________;(填操作)最后在氮气保护下将氯化锌刮出玻璃管外,保存待用。
(5)若称取100.00g市售氯化锌样品,经提纯最终得到高纯氯化锌100.3g,则样品中氯化锌纯度为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com