
分析 (1)铁和水蒸气在加热的条件下生成四氧化三铁和氢气;
(2)铁和氧气(点燃)发生化合反应生成四氧化三铁;
(3)铝与盐酸反应生成氯化铝和氢气;
(4)铝与NaOH溶液反应生成偏铝酸钠和氢气.
解答 解:(1)铁与水蒸气在加热条件下反应生成四氧化三铁和氢气,化学反应式为:3Fe+4H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2,
故答案为:3Fe+4H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2;
(2)铁和氧气(点燃)发生化合反应生成四氧化三铁,化学反应为:3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4,
故答案为:3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4;
(3)Al与盐酸反应生成氯化铝和氢气,反应为2Al+6HCl=2AlCl3+3H2↑,离子反应为2Al+6H+=2Al3++3H2↑,
故答案为:2Al+6H+=2Al3++3H2↑;
(4)铝与NaOH溶液反应生成偏铝酸钠和氢气,化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,离子反应为2Al+2H2O+2OH-=2AlO2-+3H2↑,
故答案为:2Al+2H2O+2OH-=2AlO2-+3H2↑.
点评 本题考查学生根据反应原理书写化学方程式的能力,侧重铁和铝的性质的考查,化学方程式书写经常出现的错误有不符合客观事实、不遵守质量守恒定律、不写条件、不标符号等,注意掌握离子反应方程式的技巧,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 中和热测定实验中,应迅速将NaOH溶液和盐酸在测定装置中混合 | |
| B. | 为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可 | |
| C. | 探究催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2mL5%H2O2和1mL H2O,向另一支试管中加入2mL 5%H2O2和1mL FeCl3溶液,观察并比较实验现象 | |
| D. | 已知4H++4I-+O2=2I2+2H2O,为了利用该反应探究反应速率与温度的关系,所用试剂除1 mol•L-1KI溶液、0.1 mol•L-1稀硫酸外,还需要用到淀粉溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过量CO2与澄清石灰水反应:Ca2++2OH-+CO2═CaCO3↓+H2O | |
| B. | 向KHSO4溶液中加入Ba(OH)2溶液至所得溶液的pH=7 Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| C. | 向Ca(HCO3)2溶液中滴入过量的NaOH溶液Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O | |
| D. | 硫酸铜溶液跟氢氧化钡溶液反应:Ba2++SO42-=BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将AgBr放入水中不能导电,故AgBr不是电解质 | |
| B. | CO2溶于水得到的溶液能导电,所以CO2是电解质 | |
| C. | 熔融的金属能导电,所以金属是电解质 | |
| D. | 固态的NaCl不导电,但 NaCl是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 正极 | 负极 | 电解质溶液 | |
| A | Fe | Cu | FeCl2溶液 |
| B | Cu | Fe | 稀H2SO4 |
| C | Cu | Fe | CuSO4溶液 |
| D | 石墨 | Fe | CuCl2溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
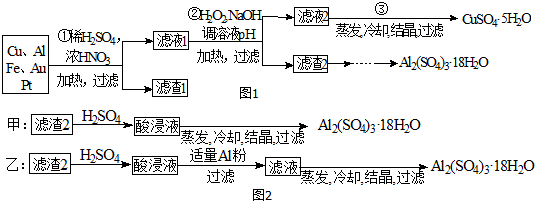
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.24mol•L-1 | B. | 0.25mol•L-1 | C. | 0.34mol•L-1 | D. | 0.35mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑥⑦ | B. | ①②④ | C. | ①②⑤ | D. | ④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 | 药品 | 制取气体 | 量气管中的液体 |
| Ⅰ | Cu、稀HNO3 | H2O | |
| Ⅱ | NaOH固体、浓氨水 | NH3 | |
| Ⅲ | Na2SO3固体、浓H2SO4 | SO2 | |
| Ⅳ | 镁铝合金、NaOH溶液(足量) | H2 | H2O |
| 编号 | 镁铝合金度量 | 量气管第一次读数 | 量气管第二次读数 |
| ① | 1.0g | 10.0mL | 346.3mL |
| ② | 1.0g | 10.0mL | 335.0mL |
| ③ | 1.0g | 10.0mL | 345.7mL |
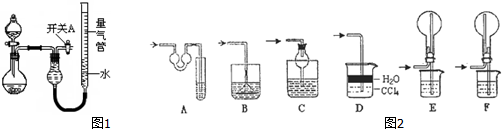
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com