
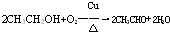 .
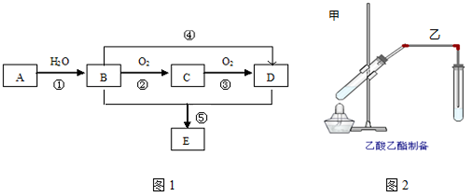
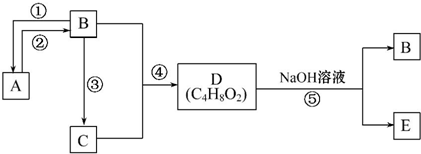
.分析 A 是一种分子量为28的气态烃,则A为CH2=CH2,以A为主要原料合成一种具有果香味的物质E,E为酯,B能连续被氧化,则B为CH3CH2OH、C为CH3CHO、D为CH3COOH、E为CH3COOCH2CH3,
(1)B中官能团是醇羟基;
(2)乙醇能被强氧化剂氧化生成乙酸;
(3)①为乙烯和水的加成反应;
②为乙醇的催化氧化反应;
(4)【实验结果】
a.甲中乙酸和乙醇在浓硫酸作催化剂加热条件下反应生成乙酸乙酯,乙酸乙酯不易溶于水且为有香味的油状液体;
b.乙酸和乙醇的反应为酯化反应,也是取代反应;
【问题探究】
乙醇和乙醇都具有挥发性,温度高时能挥发.
解答 解:A 是一种分子量为28的气态烃,则A为CH2=CH2,以A为主要原料合成一种具有果香味的物质E,E为酯,B能连续被氧化,则B为CH3CH2OH、C为CH3CHO、D为CH3COOH、E为CH3COOCH2CH3,
(1)B为CH3CH2OH,B中官能团是醇羟基,故答案为:醇羟基;
(2)乙醇能被强氧化剂氧化生成乙酸,如高锰酸钾或重铬酸钾都能氧化乙醇生成乙酸,故答案为:酸性高锰酸钾溶液或酸性重铬酸钾溶液;
(3)①为乙烯和水的加成反应,反应方程式为,为加成反应CH2=CH2+H2O$\stackrel{一定条件下}{→}$CH3CH2OH,故答案为:CH2=CH2+H2O$\stackrel{一定条件下}{→}$CH3CH2OH;加成反应;
②为乙醇的催化氧化反应,反应方程式为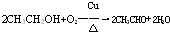 ,故答案为:
,故答案为: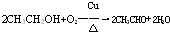 ;
;
(4)【实验结果】
a.甲中乙酸和乙醇在浓硫酸作催化剂加热条件下反应生成乙酸乙酯,乙酸乙酯不易溶于水且为有香味的油状液体,所以乙中现象是液面上有透明的不溶于水的油状液体产生,并可闻到香味,
故答案为:液面上有透明的不溶于水的油状液体产生,并可闻到香味;
b.乙酸和乙醇的反应为酯化反应,也是取代反应,反应方程式为CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,酯化反应(或取代反应)
故答案为:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;酯化反应(或取代反应);
【问题探究】
乙醇和乙醇都具有挥发性,温度高时能挥发,为防止乙醇和乙酸挥发,需要小火加热,故答案为:防止乙醇和乙酸挥发.
点评 本题考查有机合成及物质制备,为高频考点,侧重考查学生分析推断及实验制备能力,明确物质结构和性质、制备原理及实验设计是解本题关键,题目难度不大.


 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 硅单质溶于入氢氧化钠溶液中:Si+2OH-+H2O═SiO3-+2H2↑ | |
| B. | 向明矾溶液中逐滴加入Ba(OH)2溶液至沉淀物质的量最多:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | |
| C. | 在碳酸氢镁溶液中加入过量氢氧化钠溶液:Mg2++2HCO3-+2OH-═MgCO3↓+CO32-+2H2O | |
| D. | 向NaAlO2溶液中加入过量稀盐酸:AlO2-+4H+═Al3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 (1)接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:2SO2(g)+O2(g)?2SO3(g)△H=-190kJ/mol
(1)接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:2SO2(g)+O2(g)?2SO3(g)△H=-190kJ/mol| T/°C | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
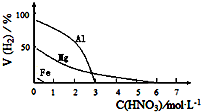 HNO3是一种氧化性的强酸,与金属反应情况多种多样.为探究HNO3性质,某兴趣小组作如下探究:
HNO3是一种氧化性的强酸,与金属反应情况多种多样.为探究HNO3性质,某兴趣小组作如下探究:| 影响因素 | 实验步骤 | 实验结论 |
| 金属的种类 | 两只烧瓶中各放入5g颗粒大小大致相同的Fe粉、Mg粉,分别加入2mol•L-1 HNO3溶液50mL,反应结束后,用气体分析仪测定气体中H2的体积分数 | 在该浓度的稀HNO3中,Mg能反应, Fe粉不反应, |
| 硝酸的浓度 | 两只烧瓶中各放入5g颗粒大小大致相同的Mg粉,分别加入0.1mol•L-1HNO3、2.0mol•L-1HNO3,反应结束后,用气体分析仪测定气体中H2的体积分数 | 硝酸浓度越稀,产生氢气越多. |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 卤族元素中Cl、Br、I在海洋中含量丰富,F在自然界中常以CaF2的形式存在.
卤族元素中Cl、Br、I在海洋中含量丰富,F在自然界中常以CaF2的形式存在. ,1molNH4NO3中含有σ键数目为7mol(或7×6.02×1023).其中阴、阳离子中心原子杂化类型分别为:sp2、sp3.
,1molNH4NO3中含有σ键数目为7mol(或7×6.02×1023).其中阴、阳离子中心原子杂化类型分别为:sp2、sp3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
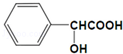
 +2Na→
+2Na→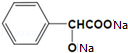 +H2↑.
+H2↑.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com