
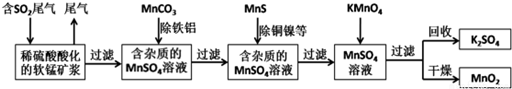
分析 由流程可知,二氧化硫能与二氧化锰反应生成硫酸锰,用MnCO3能除去溶液中Al3+和Fe3+,MnS将铜、镍离子还原为单质,高锰酸钾能与硫酸锰反应生成二氧化锰,通过过滤获得二氧化锰,
(1)过滤需要漏斗、烧杯、玻璃棒等,玻璃棒起引流作用;
(2)从消耗溶液中的酸,促进Al3+和Fe3+水解角度分析;
(3)当Ni2+恰好完全沉淀 (此时溶液中c(Ni2+)=1.0×10-5mol/L),c(S2-)=$\frac{Ksp(NiS)}{c(Ni{\;}^{2+})}$,结合Ksp(CuS)计算溶液中Cu2+的浓度;
(4)惰性电极作阳极,铁作阴极,则阳极上失去电子发生氧化反应;
(5)准确测定一定体积燃煤尾气中SO2含量,利用其还原性及明显的反应现象分析;
(6)SO2与稀硫酸酸化的软锰矿发生氧化还原反应生成硫酸锰;结合硫原子守恒可知,被吸收的SO2的物质的量等于硫酸锰晶体的物质的量.
解答 解:由流程可知,二氧化硫能与二氧化锰反应生成硫酸锰,用MnCO3能除去溶液中Al3+和Fe3+,MnS将铜、镍离子还原为单质,高锰酸钾能与硫酸锰反应生成二氧化锰,通过过滤获得二氧化锰,
(1)过滤需要漏斗、烧杯、玻璃棒等,过滤中玻璃棒的作用为引流,防止液体溅出,
故答案为:漏斗;引流,防止液体溅出;
(2)由于碳酸锰能消耗溶液中的酸,降低溶液的酸性,从而促进Al3+和Fe3+水解生成氢氧化物沉淀,
故答案为:消耗溶液中的酸,促进Al3+和Fe3+水解生成氢氧化物沉淀;
(3)当Ni2+恰好完全沉淀 (此时溶液中c(Ni2+)=1.0×10-5mol/L),c(S2-)=$\frac{Ksp(NiS)}{c(Ni{\;}^{2+})}$=$\frac{1.4×10{\;}^{-24}}{1×10{\;}^{-5}}$=1.4×10-19,由Ksp(CuS)可知溶液中Cu2+的浓度为$\frac{1.3×10{\;}^{-36}}{1.4×1{0}^{-19}}$=9.3×10-18mol/L,
故答案为:9.3×10-18;
(4)惰性电极作阳极,铁作阴极,则阳极上失去电子发生氧化反应,则阳极反应为MnO42--e-═MnO4-,
故答案为:MnO42--e-═MnO4-;
(5)准确测定一定体积燃煤尾气中SO2含量,二氧化硫与氨水、NaOH反应不易控制,且加指示剂现象观察的滴定终点与反应终点误差大,而b、c中利用还原性及高锰酸钾褪色、淀粉变蓝等可准确测定气体的含量,
故答案为:bc;
(6)SO2与稀硫酸酸化的软锰矿发生氧化还原反应生成硫酸锰,反应方程式为SO2+MnO2=MnSO4,由硫原子守恒,被吸收的SO2的物质的量等于硫酸锰晶体的物质的量,则硫酸锰晶体的质量为$\frac{1000m{\;}^{3}×6.4g/m{\;}^{3}×90%}{64g/mol}$×169g/mol≈15.2kg,
故答案为:SO2+MnO2=MnSO4; 15.2.
点评 本题以物质的制备实验考查混合物分离提纯的综合应用,为高频考点,涉及氧化还原反应、盐类水解、溶度积计算、原子守恒计算等,把握流程分析及混合物分离方法、发生的反应为解答的关键,侧重分析与实验、计算能力的考查,综合性较强,题目难度中等.


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:解答题
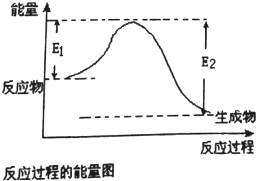 已知E1=2218kJ•mol-1、E2=2752kJ•mol-1,按要求回答问题:
已知E1=2218kJ•mol-1、E2=2752kJ•mol-1,按要求回答问题: ,已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N-N为154、O-H为460,则断裂1mol N-H键所需的能量(kJ)是391kJ.
,已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N-N为154、O-H为460,则断裂1mol N-H键所需的能量(kJ)是391kJ.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶质的质量分数为ω=$\frac{a}{{V}_{ρ}-a}$×100% | |
| B. | 溶质的物质的量浓度c=$\frac{1000a}{17V}$mol•L-1 | |
| C. | 溶液中c(OH-)=$\frac{1000b}{V}$mol•L-1+c(H+) | |
| D. | 上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 溶液与胶体属于包含关系 | |
| B. | 化合物与氧化物属于包含关系 | |
| C. | 电解质与化合物属于交叉关系 | |
| D. | 氧化还原反应与化合反应属于并列关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸银溶液中加入氯化钠:Ag++Cl-═AgCl↓ | |
| B. | 稀 H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氢氧化钡溶液与稀 H2SO4 反应:Ba2++SO42-═BaSO4↓ | |
| D. | 碳酸钙与盐酸反应:CO32-+2H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠久置于空气中,先变暗,再变白,又“出汗”,最后变成白色固体 | |
| B. | 由海水制备金属镁和游离态的溴 | |
| C. | 工业上用石灰石、石英、纯碱制玻璃 | |
| D. | 高温下用二氧化硅和碳反应制备粗硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com