
分析 (1)根据盖斯定律来计算丙烷完全燃烧的反应热;
(2)①利用平衡的特征“等”、“定”及由此衍生的一些量来分析;
②据方程式结合三段式列式计算,转化率=$\frac{消耗量}{起始量}$×100%;
(3)①碳酸钠是强碱弱酸盐,能发生水解生成碳酸氢钠和氢氧化钠而使溶液呈碱性;依据水解平衡常数和电离平衡常数计算溶液PH;
②根据二氧化碳和氢氧化钠之间反应量的关系:按照1:1反应,产物是碳酸氢钠,按照1:2反应,产物是碳酸钠来分析回答;
③根据原子守恒和电荷守恒计算c(OH-)-c(H+)的值;
(4)该燃料电池中,正极上氧气得电子和二氧化碳反应生成碳酸根离子,总电极反应式减去正极反应式可得负极电极反应式;
(5)Na2CO3溶液的浓度为2×10-4mol/L,等体积混合后溶液中c(CO32-)=1×10-4mol/L,根据Ksp=c(CO32-)•c(Ca2+)计算沉淀时混合溶液中c(Ca2+),原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍.
解答 解:(1)由①2C3H8(g)+7O2 (g)=6CO (g)+8H2O△H1=-2741.8kJ/mol,
②2CO (g)+O2(g)=2CO2 (g)△H2=-566kJ/mol,
根据盖斯定律可知,$\frac{①+②×3}{2}$可得C3H8(g)+5O2 (g)=3CO2 (g)+4H2O,
其反应热为$\frac{(-2741.8KJ/mol)+(-566KJ/mol)×3}{2}$=-2219.9KJ/mol,
故答案为:-2219.9KJ/mol;
(2)①a.由反应可知,反应前后的压强始终不变,则体系中的压强不发生变化,不能判断平衡,故a错误;
b.v正(H2)=v逆(CO),说明一氧化碳正逆反应速率相同,说明反应达到平衡状态,故b正确;
c.,因体积不变,气体的总质量不变,所以混合气体的密度始终不变,不发生变化,不能判断平衡,故c错误;
d.CO2的浓度不再发生变化,由平衡的特征“定”可知,则化学反应达到平衡,故d正确;
故答案为:bd;
②到平衡后,CO的转化率为60%,则CO的转化的物质的量浓度为1mol/L×60%=0.6mol/L,依据化学平衡三段式列式得到
CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol/L) 1 2.4 0 0
变化量(mol/L) 0.6 0.6 0.6 0.6
平衡量(mol/L) 0.4 1.8 0.6 0.6
平衡常数K=$\frac{0.6×0.6}{0.4×1.8}$=0.5;
故答案为:0.5;
(3)①碳酸钠是强碱弱酸盐,能发生两步水解,第一步水解生成碳酸氢根离子和氢氧根离子,水解方程式为:CO32-+H2O?HCO3-+OH-,Kb=$\frac{C(HC{{O}_{3}}^{-})c(O{H}^{-})}{c(C{{O}_{3}}^{2-})}$=2×10-4,又c(HCO3-):c(CO32-)=2:1,则c(OH-)=10-4,结合KW=10-14,可得c(H+)=10-10,pH=10,
故答案为:CO32-+H2O?HCO3-+OH-;10;
碳酸钠溶液中分步水解显碱性溶液中离子浓度大小为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+);
c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+);
②根据二氧化碳和氢氧化钠之间反应量的关系:按照1:1反应,产物是碳酸氢钠,按照1:2反应,产物是碳酸钠,0.4molCO2和200mL 3mol/L NaOH溶液混合,二者的物质的量之比是2:3,所的溶液是碳酸钠和碳酸氢钠的混合物,混合物显碱性c(OH-)>c(H+),碳酸根离子水解程度大与碳酸氢根离子的水解程度,所以c(CO32-)<c(HCO3-),即c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
故答案为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
③根据原子守恒和电荷守恒计算c(OH-)-c(H+)的值,根据碳原子守恒得,c(CO32-)+c(HCO3- )+c(H2CO3)=0.1mol/L,根据溶液中电荷守恒得:2×c(CO32-)+c(HCO3- )+c(OH-)=c(Na+ )+c(H+ ),c(Na+ )=0.2mol/L,所以c(OH-)-c(H+)=c(HCO3- )+2c(H2CO3),
故答案为:c(HCO3- )+2c(H2CO3);
(4)该熔融盐燃料电池中,正极上氧气得电子和二氧化碳反应生成碳酸根离子,电极反应式为:O2+2CO2+4e-═2 CO32-,电池总反应方程式为2CO+O2=2CO2,减去正极反应式可得负极电极反应式为:CO+CO32--2e-═2CO2,
故答案为:CO+CO32--2e-═2CO2;
(5)Na2CO3溶液的浓度为2×10-4mol/L,等体积混合后溶液中c(CO32-)=$\frac{1}{2}$×2×10-4mol/L=1×10-4mol/L,根据Ksp=c(CO32-)•c(Ca2+)=3.8×10-9可知,c(Ca2+)=$\frac{3.8×1{0}^{-9}}{1×1{0}^{-4}}$mol/L=3.8×10-5mol/L,原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液CaCl2溶液的最小浓度为2×3.8×10-5mol/L=7.6×10-5mol/L.
故答案为:7.6×10-5mol/L.
点评 本题以金属的冶炼为载体,考查化学工艺流程、电解原理、离子浓度大小比较、信息获取等问题,有利于培养学生分析解决问题能力、信息获取与知识移运用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L稀硫酸中含有硫酸根数目为0.1NA | |
| B. | 9g H2O中含有H数目为1mol | |
| C. | 2.4g金属镁与足量的盐酸反应,生成氢分子数目为2NA | |
| D. | 1mol NH4+中含有电子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | C-C | C-H | H-H | C-O | C=O | H-O |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | 750 | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
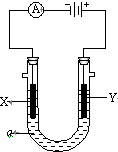 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
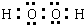 ;[Fe(C2O4)3]3-的名称是三草酸合铁(Ⅲ)离子(或三草酸合铁离子,或三草酸合铁酸根).
;[Fe(C2O4)3]3-的名称是三草酸合铁(Ⅲ)离子(或三草酸合铁离子,或三草酸合铁酸根).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
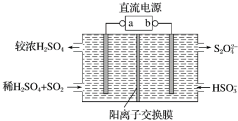 利用图中所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2.下列说法正确的是( )
利用图中所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2.下列说法正确的是( )| A. | a为直流电源的负极 | |
| B. | 一段时间后,阴极区溶液的pH减小 | |
| C. | 阳极的电极反应式为SO2+2H2O-2e-=SO42-+4H+ | |
| D. | 电解时,H+由阴极室通过阳离子交换膜到阳极室 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com