
| A. | 太阳能电池的主要材料是高纯度的二氧化硅 | |
| B. | 铜锌原电池工作时,电子从铜电极沿外电路流向锌电极 | |
| C. | 铅蓄电池的负极为PbO2,属于二次电池 | |
| D. | 锌锰干电池中,锌电极是负极 |
分析 A.太阳能电池的主要材料是硅;
B.铜锌原电池放电时,电子从负极沿导线流向正极;
C.铅蓄电池的负极为Pb,属于二次电池;
D.锌锰干电池中易失电子的物质作负极.
解答 解:A.太阳能电池的主要材料是半导体硅,光导纤维的主要材料是二氧化硅,故A错误;
B.铜锌原电池中锌易失电子作负极,铜作正极,放电时,电子从负极锌沿导线流向正极铜,故B错误;
C.铅蓄电池的负极为Pb,正极为PbO2,属于二次电池,故C错误;
D.锌锰干电池中易失电子的物质作负极,锌易失电子发生氧化反应而作负极,故D正确;
故选D.
点评 题考查了原电池原理,明确正负极上反应类型、电子流向以及电极材料的判断即可解答,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液与醋酸反应 | B. | KOH溶液与稀盐酸反应 | ||
| C. | Ba(OH)2溶液与稀硫酸反应 | D. | Cu(OH)2与稀硝酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阳极附近溶液呈红色 | B. | 阳极逸出气体 | ||
| C. | 阴极附近溶液呈蓝色 | D. | 溶液的PH变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
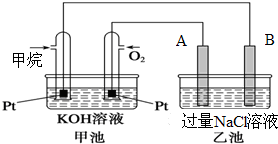 如图所示是甲烷燃料电池工作时的装置,乙池中的两个电极一个是石墨电极,一个是铜电极,工作时A、B两个电极的质量都不减少,请回答下列问题:
如图所示是甲烷燃料电池工作时的装置,乙池中的两个电极一个是石墨电极,一个是铜电极,工作时A、B两个电极的质量都不减少,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+,无K+ |
| B | 将SO2和CO2气体分别通入水中至饱和,立即用pH计测两溶液的pH | 前者的pH小于后者 | H2SO3酸性强于H2CO3 |
| C | 铝热剂溶于足量稀盐酸再滴加KSCN溶液 | 未出现血红色 | 铝热剂中不能确定是否含有铁的氧化物 |
| D | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入几滴新制Cu(OH)2悬浊液,加热 | 没有红色沉淀生成 | 淀粉没有水解成葡萄糖 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com