
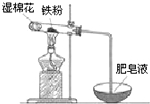
 铝和铁是日常生活中用途广泛的金属.
铝和铁是日常生活中用途广泛的金属.分析 (1)常温下,铁、铝在浓硝酸、浓硫酸中发生钝化,不能继续发生反应;
(2)铝是两性元素和强酸强碱发生反应,铝与碱反应生成偏铝酸盐和氢气;
(3)工业上采用电解熔融氧化铝的方法冶炼铝;
(4)①湿棉花含有水蒸气,对反应来说提供了水,铁在高温下与水反应生成四氧化三铁和氢气,据此分析解答即可;
②产物四氧化三铁中有+2价的铁和+3价的铁,还有可能有过量的铁.
解答 解:(1)铝和铁在常温下遇到浓硫酸或浓硝酸会发生钝化,表面生成一层致密的氧化膜阻止反应的进一步进行,所以生活中常用铝制或铁制的容器来运输或盛装浓硫酸或浓硝酸,
故答案为:浓硫酸使铁、铝表面形成一层致密稳定的氧化膜(或使铁、铝钝化);
(2)铝与碱反应生成偏铝酸盐和氢气,反应的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)工业上采用电解熔融氧化铝的方法冶炼铝,反应方程式为:2Al2O3$\frac{\underline{\;电解\;}}{\;}$ 4Al+3O2↑,
故答案为:2Al2O3$\frac{\underline{\;电解\;}}{\;}$ 4Al+3O2↑;
(4)①因为是铁和水蒸气的反应,试管内有铁粉,所以湿棉花主要是提供水蒸气;铁在高温下与水反应生成四氧化三铁和氢气,反应方程式为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,
故答案为:提供水蒸气;3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;
②铁和水蒸气反应,产物为四氧化三铁和氢气,加入过量盐酸,固体完全溶解,必发生反应:Fe3O4+8HCl=FeCl2+2FeCl3+4H2O,所以所得溶液中存在的阳离子是一定有Fe2+、H+,四氧化三铁黑色固体中可能含有过量的铁,可能将三价铁离子全部转化成二价铁离子,Fe+2Fe3+═3Fe2+,所以所得溶液中存在的阳离子是一定有Fe2+、H+,可能有Fe3+,
故答案为:b.
点评 本题考查铁及其化合物的性质实验、铝及其化合物的性质,结合相关的化学反应原理是解答的关键,本题难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 变化过程 | 现象 |
| A | 将少量酚酞滴加到过氧化钠固体上 | 变红 |
| B | 将过量氯气通入紫色石蕊试液中 | 褪色 |
| C | 过量氨水逐滴加入氯化铝溶液中 | 先产生白色沉淀后白色沉淀消失 |
| D | 氢氧化铁胶体中加入过量稀硫酸 | 先产生红褐色沉淀后溶解,溶液变为黄色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF+H2O?H3O++F- | |
| B. | NaHCO3=Na++HCO3-,HCO3-?H++CO32- | |
| C. | Ag2S(s)?2Ag+(aq)+S2-(aq) | |
| D. | S2-+2H2O?H2S+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com