
| t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
| c(N2O5)/(mol•L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
分析 (1)依据平衡常数表达式书写热化学方程式,结合已知的热化学方程式和盖斯定律计算得到缩小热化学方程式的焓变,得到此反应的热化学方程式;
(2)①相同条件下,气体的物质的量之比等于其压强之比;
2N2O5(g)═4NO2(g)+O2(g)
开始(mol/L)1.00 0 0
反应(mol/L)0.65 1.3 0.325
2min(mol/L)0.35 1.3 0.325
反应前后气体的压强之比等于其物质的量之比;
先计算五氧化二氮的反应速率,再根据同一时间段内各物质的反应速率之比等于其计量数之比计算氧气反应速率;
②根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(3)化学平衡常数K=$\frac{生成物平衡分压幂次方乘积}{反应物平衡分压幂次方乘积}$;
(4)根据电荷守恒及电离常数进行计算.
解答 解:(1)若某反应的平衡常数表达式为:k=$\frac{c({N}_{2})•{c}^{2}(C{O}_{2})}{{c}^{2}(NO)•{c}^{2}(CO)}$,反应为2NO(g)+2CO(g)?N2(g)+2CO2(g),
①N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-l
②C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-l
③2C(s)+O 2(g)=2CO(g)△H=-221kJ•mol-l
盖斯定律计算②×2-③-①得到2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.5 kJ•molˉ1,
故答案为:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.5 kJ•molˉ1;
(2)①相同条件下,气体的物质的量之比等于其压强之比;
2N2O5(g)═4NO2(g)+O2(g)
开始(mol/L)1.00 0 0
反应(mol/L)0.65 1.30 0.325
2min(mol/L)0.35 1.30 0.325
反应前后气体的压强之比等于其物质的量之比,所以p:p0=(0.35+1.30+0.325)mol:1.00mol=1.975,2.00min~5.00min内,v(N2O5)=$\frac{0.5-0.17}{5-2}$mol/(L.min)=0.11mol/(L.min),再根据同一时间段内各物质的反应速率之比等于其计量数之比得氧气反应速率=$\frac{1}{2}$v(N2O5)=0.055mol•L-1•min-1,
故答案为:1.975; 0.055 mol•Lˉ1•minˉ1;
②a.容器中压强不再变化,反应已达到化学平衡状态,故a正确;
b.NO2和O2的体积比始终都不变,不能确定反应是否达到化学平衡状态,故b错误;
c.υ正(NO2)=2υ逆(N2O5)才表明达到化学平衡状态,故c错误;
d.平衡时,气体的平均相对分子质量为大于43.2,且保持不变.故d错误.
故答案为:a;
(3)四氧化二氮的转化率是0.4,设原来四氧化二的物质的量为xmol,转化的物质的量为0.8xmol,则混合气体的物质的量=(x-0.4x+0.8x)mol=1.4xmol,相同条件下,气体的压强之比等于其物质的量之比,所以反应后压强=$\frac{200KPa}{1.4xmol}$=280KPa,
四氧化二氮的分压=280KPa×$\frac{0.6xmol}{1.4xmol}$=120KPa,
二氧化氮的分压=280KPa×$\frac{0.8x}{1.4x}$=160KPa,
化学平衡常数K=$\frac{生成物平衡分压幂次方乘积}{反应物平衡分压幂次方乘积}$=$\frac{16{0}^{2}}{120}$=213.3KPa,
故答案为:213.3KPa;
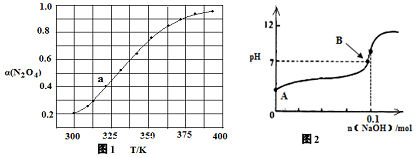
(4)由电荷守恒式c(Na+)+c(H+)=c(OH-)+c(N3-)和B点时溶液的pH=7得:c(Na+)=c(N3-)
设氢氧化钠的物质的量为xmol
依据HN3?H++N3-的电离平衡:K=1×10-5=$\frac{c({H}^{+})c({{N}_{3}}^{-})}{c()H{N}_{3}}$=$\frac{1{0}^{-7}×x}{0.1-x}$
解得:x=0.099mol
故答案为:0.099.
点评 本题考查化学平衡有关计算,为高频考点,涉及平衡计算、盖斯定律等知识点,侧重考查学生分析计算及获取信息解答问题能力,难点是(3)题平衡常数的计算,注意分压的计算方法,题目难度中等.


科目:高中化学 来源: 题型:选择题
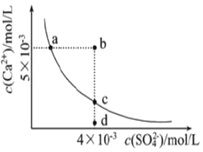
| A. | a、c两点均可以表示常温下CaSO4溶于水所形成的饱和溶液 | |
| B. | a点对应的Ksp不等于c点对应的Ksp | |
| C. | b点将有沉淀生成,平衡后溶液中c(Ca2+)•c(SO42-)一定等于9×10-6 | |
| D. | 向d点溶液中加入适量CaCl2固体可以变成c点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 25℃时,NH3•H2O的电离平衡常数Kb=1.75×10-5,该温度下,用0.01mol•L-1盐酸滴定10mL a mol•L-1氨水,盐酸的体积V(HCl)与溶液的pH关系如图所示,下列说法正确的是( )
25℃时,NH3•H2O的电离平衡常数Kb=1.75×10-5,该温度下,用0.01mol•L-1盐酸滴定10mL a mol•L-1氨水,盐酸的体积V(HCl)与溶液的pH关系如图所示,下列说法正确的是( )| A. | A点溶液中加少量水,$\frac{c({H}^{+})}{c(N{{H}_{4}}^{+})}$减小 | |
| B. | 原氨水的物质的量浓度约为1.006×10-2mol•L-1 | |
| C. | A、B、C三点溶液中水电离出来的c(OH-):A>B>C | |
| D. | C点时,盐酸和氨水恰好完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用醋酸除去水垢中的碳酸钙:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 硫化钠水溶液呈碱性的原因:S2-+2H2O?H2S↑+2OH- | |
| C. | 向NaHCO3溶液中加入少量的Ba(OH)2溶液:Ba2++OH-+HCO3-═BaCO3↓+2H2O | |
| D. | 向Na2FeO4溶液中加入稀硫酸产生氧气:4FeO42-+20H+═4Fe3++3O2↑+10H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、I-、K+、Br2 | B. | Mg2+、Cu2+、SO42-、NO3- | ||
| C. | Fe2+、Cl2、K+、SO42- | D. | ClO-、Cl-、CO2、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com