
| A、NH4Cl |
| B、NaCl |
| C、CH3COONa |
| D、NaNO3 |
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
| 除杂试剂 | ①酸性高锰酸钾溶液 ②溴水 ③饱和碳酸钠溶液 ④氢氧化钠溶液 |
| 提纯方法 | A蒸馏 B萃取 C分液 D洗气 |
| 甲 | 除杂试剂 | 提纯方法 |
| 甲烷(乙烯) | ||
| 乙酸乙酯(乙酸) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、Na+、OH-、MnO4- |
| B、Ba2+、Cu2+、NO3-、SO42- |
| C、Mg2+、Na+、OH-、SO42- |
| D、Cl-、Ba2+、NO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
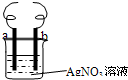 用铜丝(电极a)、银丝(电极b)和AgNO3溶液可以构成原电池或电解池,如图.则下列说法正确的是( )
用铜丝(电极a)、银丝(电极b)和AgNO3溶液可以构成原电池或电解池,如图.则下列说法正确的是( )| A、构成原电池时b极反应为:Cu2++2e-=Cu |
| B、构成电解池时a极质量一定减少 |
| C、构成电解池时b极质量可能减少 |
| D、构成的原电池或电解池工作后都会产生大量气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4种 | B、8种 |
| C、12种 | D、16种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 运用化学反应原理研究氮、硫等单质及其化合物的反应有重要意义
运用化学反应原理研究氮、硫等单质及其化合物的反应有重要意义
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 结构及性质 |
| A | A的原子半径最小 |
| X | X原子最外层电子数是次外层的两倍 |
| D | D是短周期中金属性最强的元素 |
| E | E的最高价氧化物对应水化物是一种常见的两性氢氧化物 |
| R | R与X同主族 |
| T | T的负一价阴离子的核外电子排布与Ar原子相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com