
【题目】有机物的结构简式如图,则此有机物可发生的反应类型有( )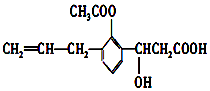
①取代 ②加成 ③消去④酯化⑤水解⑥氧化⑦中和 ⑧加聚.
A.①②③⑤⑥
B.②③④⑤⑥⑧
C.②③④⑤⑥⑦
D.①②③④⑤⑥⑦⑧
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
SO2(g)+2CO(g) ![]() 2CO2(g)+S(s)
2CO2(g)+S(s)
若反应在恒容的密闭容器中进行,下列有关说法正确的是( )
A.平衡前,随着反应的进行,容器内压强始终不变
B.平衡时,其他条件不变,分离出硫,正反应速率加快
C.平衡时,若升高温度,CO体积分数增大,则该反应的△H>0
D.其他条件不变,使用不同催化剂,该反应平衡常数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】提供如下试剂:烧碱、铜片、大理石、蒸馏水,欲进行以下物质的制取或实验,从欠缺试剂的角度看,无法进行的是( )
A.制取纯碱B.制取氧化铜
C.测定烧碱的物质的量D.制取氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生物体生命活动的主要承担者、遗传信息的携带者、结构和功能的基本单位、生命活动的主要能源物质依次是 ( )
A.核酸、蛋白质、细胞、糖类 B.蛋白质、核酸、细胞、脂肪
C.蛋白质、核酸、细胞、糖类 D.核酸、蛋白质、糖类、细胞
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业废液里含有FeCl2、CuCl2和FeCl3 . 为回收铜并得到纯净的FeCl3溶液,下面是综合利用的主要流程: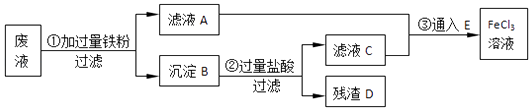
(1)A的化学式为 , E的化学式为 .
(2)B的化学成份 , 回收的铜是(填A、B、C、D或E).
(3)根据图示,反应②的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.![]() 的一溴代物和
的一溴代物和 ![]() 的一溴代物都有4种(不考虑立体异构)
的一溴代物都有4种(不考虑立体异构)
B.C5H11Cl有3种同分异构体
C.按系统命名法,化合物 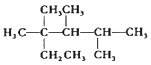 的名称是2,3,4﹣三甲基﹣2﹣乙基戊烷
的名称是2,3,4﹣三甲基﹣2﹣乙基戊烷
D.CH3CH═CHCH3分子中的四个碳原子在同一直线上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氧化三铅(Pb3O4,也可写作2PbO·PbO2)俗名“铅丹”或“红丹”,可用作防锈剂。工业上以废旧铅酸电池的铅膏(主要成分是PbSO4和PbO2)为原料制备Pb3O4的流程如下:

(1)“还原”时的化学方程式为________。
(2)已知:Ksp[PbCO3]=1.5×10-13。若使溶液中Pb2+的浓度小于1×10-5 molL-1,此时溶液中的c(CO32-) > ________molL-1。
(3)为测定某样品四氧化三铅含量,称取样品0.1200g,加入足量的6 molL-1HNO3充分溶解,过滤,得到含Pb2+的滤液和PbO2固体。将固体PbO2连同滤纸一并置于另一只锥形瓶中,加入足量的醋酸和醋酸钠混合溶液,再加入过量KI,使PbO2充分氧化I-,以淀粉溶液作指示剂,用0.01000molL-1 Na2S2O3溶液滴定,终点时用去30.00 mL。已知:I2 + 2Na2S2O3 = Na2S4O6 + 2NaI。
①所加KI必须过量,原因是________。
②计算试样中Pb3O4的质量分数_____。(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
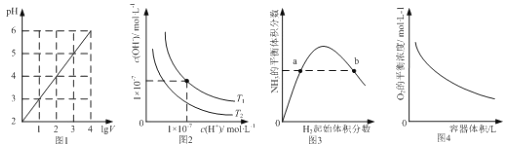
A. 图1表示1LpH=2的CH3COOH溶液加水稀释至VL,pH随1gV的变化
B. 图2表示不同温度下水溶液中H+和OH-浓度的变化的曲线,图中温度T1 <T2
C. 图3表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率小于b点
D. 图4表示同一温度下,在不同容积的容器中进行反应2BaO2(s)2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得,反应原理为:
①Na2CO3+SO2=Na2SO3+CO2
②Na2S+SO2+H2O=Na2SO3+H2S
③2H2S+SO2=3S↓+2H2O
④Na2SO3+ S ![]() Na2S2O3,
Na2S2O3,
常温下溶液中析出晶体为Na2S2O35H2O。Na2S2O3·5H2O于40~45℃熔化,48℃分解;Na2S2O3 易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如图所示。
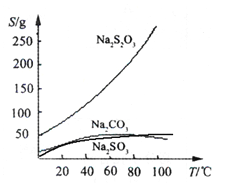
Ⅰ.现按如下方法制备Na2S2O3·5H2O:
将硫化钠和碳酸钠按反应要求比例一并放入三颈烧瓶中,注入150mL蒸馏水使其溶解,在分液漏斗中,注入浓盐酸,在装置2中加入亚硫酸钠固体,并按下图安装好装置。
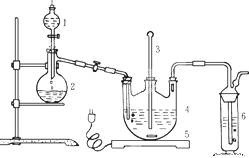
请问:(1)仪器2的名称为________,装置6中可放入_________。
A.BaCl2溶液 B.浓H2SO4
C.酸性KMnO4溶液 D.NaOH溶液
(2)打开分液漏斗活塞,注入浓盐酸使反应产生的二氧化硫气体较均匀的通入Na2S和Na2CO3的混合溶液中,并用磁力搅拌器搅动并加热。随着二氧化硫气体的通入,看到溶液中有大量浅黄色固体析出。持续通二氧化硫气体,反应约半小时。当溶液中pH接近或不小于7时,即可停止通气和加热。溶液pH要控制不小于7理由是________(用离子方程式表示)。
Ⅱ.分离Na2S2O3·5H2O并标定溶液的浓度:
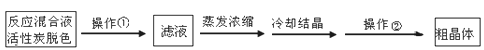
(1)为减少产品的损失,操作①为______,操作②是_____、洗涤、干燥,其中洗涤操作是用_________(填试剂)作洗涤剂。
(2)蒸发浓缩滤液直至溶液呈微黄色浑浊为止,蒸发时为什么要控制温度不宜过高_______。
(3)称取一定质量的产品配制成硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:用分析天平准确称取基准物质K2Cr2O7(摩尔质量294g/mol)0.5880克。平均分成3份分别放入3个锥形瓶中,加水配成溶液,并加入过量的KI并酸化,发生下列反应:![]() 6I-+Cr2O72-+14H+=3I2+2Cr3++7H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应: I2+2S2O32-=2I-+S4O62-,滴定终点的现象为_____________________。三次消耗Na2S2O3溶液的平均体积为20.00mL,则所标定的硫代硫酸钠溶液的浓度为_________ mol/L。
6I-+Cr2O72-+14H+=3I2+2Cr3++7H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应: I2+2S2O32-=2I-+S4O62-,滴定终点的现象为_____________________。三次消耗Na2S2O3溶液的平均体积为20.00mL,则所标定的硫代硫酸钠溶液的浓度为_________ mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com