
分析 (1)碳酸氢钠足量,反应生成碳酸钙、碳酸钠和水;
(2)反应后溶液呈中性,氢离子与氢氧根离子恰好反应;
(3)氢氧化钙足量,反应生成碳酸钙沉淀、氢氧化钠和水;
(4)铁粉过量,反应生成硝酸亚铁、NO气体和水;
(5)溴化亚铁少量,亚铁离子和溴离子都被氯气氧化;
(6)二氧化硫被次氯酸根离子氧化成硫酸,反应生成硫酸钙沉淀、次氯酸和氯化钠;
(7)二氧化碳过量,反应生成氢氧化铝沉淀和碳酸氢钠.
解答 解:(1)Ca(OH)2溶液与足量NaHCO3溶液反应,离子方程式按照氢氧化钙的化学式组成书写,反应的离子方程式为:2HCO3-+2OH-+Ca2+=CaCO3↓+2H2O+CO32-,
故答案为:2HCO3-+2OH-+Ca2+=CaCO3↓+2H2O+CO32-;
(2)NaHSO4溶液中,逐滴加入Ba(OH)2溶液至中性,硫酸氢钠与氢氧化钡按照物质的量2:1反应,反应的离子方程式为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,
故答案为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O;
(3)足量Ca(OH)2溶液与NaHCO3溶液反应生成碳酸钙沉淀、NaOH和水,反应的离子方程式为:HCO3-+OH-+Ca2+=CaCO3↓+H2O,
故答案为:HCO3-+OH-+Ca2+=CaCO3↓+H2O;
(4)过量的铁粉与稀硝酸反应,生成硝酸亚铁,铁元素的化合价变化为0→+2,所以一个铁原子失去2个电子,氮元素的化合价变化为+5→+2,一个参加氧化还原反应的硝酸根离子得到3个电子,得失的最小公倍数是6,铁的计量数是3,NO的计量数是2,其它元素根据原子守恒进行配平,反应的离子方程式为:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O,
故答案为:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O;
(5)足量的氯气与少量溴化亚铁溶液反应时,亚铁离子和溴离子都完全反应,反应的离子方程式为:3Cl2+2Fe2++4Br-=6Cl-+2Fe3++2Br2,
故答案为:3Cl2+2Fe2++4Br-=6Cl-+2Fe3++2Br2;
(6)少量二氧化硫通入漂白粉溶液中,二者发生氧化还原反应,反应的化学方程式为:Ca2++3ClO-+H2O+SO2═CaSO4↓+2HClO+Cl-,
(7)偏铝酸钠可以和过量二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,反应的离子方程式为:AlO2-+2H2O+CO2═Al(OH)3↓+HCO3-,
故答案为:AlO2-+2H2O+CO2═Al(OH)3↓+HCO3-.
点评 本题考查了离子方程式的书写,题目难度中等,明确发生反应实质为解答关键,注意熟练掌握离子方程式的书写原则,试题培养了学生的灵活应用能力.


 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案科目:高中化学 来源: 题型:解答题
| 物质 选项 | n(CO) | n(H2O) | n(CO2) | n(H2) |
| A | 0mol | 4mol | 2mol | 2mol |
| B | 0.5mol | 2.5mol | 0.5mol | 0.5mol |
| C | 1mol | 4mol | 0.5mol | 0.5mol |
| D | 0mol | 0mol | 1mol | 3mol |
| 物质 选项 | n(CO) | n(H2O) | n(CO2) | n(H2) |
| A | 0mol | 0mol | 1mol | 3mol |
| B | 2.5mol | 0.5mol | 0.5mol | 0.5mol |
| C | 3mol | 1mol | 0mol | 0mol |
| D | 0mol | 0mol | 3mol | 1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同物质的量的浓度的三种溶液:Na2SO4、MgSO4、Al2(SO4)3,其体积比为3:2:1,则SO42-浓度之比为1:1:3 | |
| B. | 将10 mL 1 mol/L H2SO4稀释成0.1 mol/L的H2SO4,可向该溶液中加入100 mL水 | |
| C. | 将1 mol/L的NaCl溶液和0.5 mol/L的BaCl2溶液等体积混合后,不考虑溶液体积变化c(Cl-)=0.75 mol/L | |
| D. | 50 g浓度为c mol/L,密度为ρ g•cm-3的氨水(ρ<1)中加入一定量的水(ρ=1g•cm-3)稀释成0.5c mol/L,则加入水的体积应小于50 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 反应物质 | 反应结果 | 影响因素 |
| A | Zn H2SO4 | H2 SO2 | 锌的还原性 |
| B | Na O2 | Na2O Na2O2 | 反应温度 |
| C | FeCl3溶液Na2S溶液 | 淡黄色或者黑色浑浊 | Na2S溶液加入量 |
| D | AlC13溶液 NaOH溶液 | 澄淸或者浑浊 | 试剂加入顺序 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
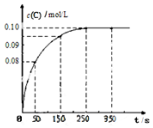 在一定温度下,向2L恒容密闭容器中充入1mol A,发生A(g)?B(g)+C(g)反应.反应过程中c(C)随时间变化的曲线如图所示,下列说法不正确的是( )
在一定温度下,向2L恒容密闭容器中充入1mol A,发生A(g)?B(g)+C(g)反应.反应过程中c(C)随时间变化的曲线如图所示,下列说法不正确的是( )| A. | 反应在 0~50 s 的平均速率=1.6×10-3mo1/(L•s) | |
| B. | 该温度下,反应的平衡常数值为0.025 | |
| C. | 反应平衡后,再向容器中充入A、B、C各1mol,此时v(正)<v(逆) | |
| D. | 保持其他条件不变,升高温度,平衡时c(B)=0.11mol/L,则该反应的△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在 16g18O2中含有NA个氧原子 | |
| B. | 16gCH4中含有4NA个C-H 键 | |
| C. | 22g 某气体含分子数为 0.5NA,则其摩尔质量为 44 | |
| D. | 含 NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为 1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2S和SO2 | B. | O2 | C. | H2S | D. | SO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com