
A、CH3CH=CH2 烯烃  |
B、 羧酸-COOH 羧酸-COOH |
C、 羧酸类-COOH 羧酸类-COOH |
| D、R-OH(R为链烃基) 醇类-OH |
 ,故A正确;
,故A正确; 为甲酸与苯甲醇生成的酯,故C错误;
为甲酸与苯甲醇生成的酯,故C错误;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、①③④ | B、①④⑥ |
| C、②④⑤ | D、只有① |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、生成物能量一定低于反应物总能量 |
| B、相同条件下,2mol氢原子所具有的能量小于1mol氢分子所具有的能量 |
| C、根据盖斯定律,可计算某些难以直接测定的化学反应的反应焓变 |
| D、同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件的△H不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、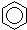 +HNO3 +HNO3
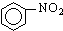 +H2O;取代反应 +H2O;取代反应 | |||
| B、CH4+Cl2→CH3Cl+HCl;置换反应 | |||
C、CH2═CH2+H2O
| |||
D、2CH3CH2OH+O2
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:钠>磷>氟>氢 |
| B、酸性:HClO4>H2SO4>H3PO4 |
| C、热稳定性:碘化氢>溴化氢>氟化氢 |
| D、还原性:S2->Cl->F- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蒸馏水 |
| B、FeCl3溶液 |
| C、新制Cu(OH)2悬浊液 |
| D、NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、T、X、Y、Z是中学化学常见的四种元素,原子序数依次增大,其结构或性质信息如下表:
A、T、X、Y、Z是中学化学常见的四种元素,原子序数依次增大,其结构或性质信息如下表:| 元素 | 结构或性质信息 |
| T | 基态原子的L层上s电子数等于p电子数 |
| X | 基态原子最外层未成对电子数在该元素所在周期中最多 |
| Y | 基态原子的第一电离能在该元素所在周期中最小 |
| Z | 单质常温、常压下是气体.基态原子的M层上有1个未成对的p电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)已知:常压下,氨气在300℃时约有9.7%分解,水蒸气在2000℃时约有4%分解,氟化氢气体在3000℃时仍不分解.则这三种物质的稳定性由强到弱的顺序是
(1)已知:常压下,氨气在300℃时约有9.7%分解,水蒸气在2000℃时约有4%分解,氟化氢气体在3000℃时仍不分解.则这三种物质的稳定性由强到弱的顺序是查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com