
| A. |  | B. |  | C. |  | D. | (CH3)2CH(CH2)4CH3 |
 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加成反应、取代反应 | B. | 加成反应、消去反应 | ||
| C. | 取代反应、消去反应 | D. | 取代反应、加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用分液漏斗分离硬脂酸钠与甘油的混合物 | |
| B. | 容量瓶用蒸馏水洗涤后须烘干才能使用 | |
| C. | 分馏石油时,温度计的水银球必须插入液面以下 | |
| D. | 氯化钠溶液蒸发结晶时,蒸发皿中有大量晶体析出并剩余少量溶液时应停止加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,4.5g${\;}_{7}^{15}$N${\;}_{3}^{+}$所含电子数为2NA个 | |
| B. | 1molFeCl3跟沸水完全反应转化为氢氧化铁胶体,其中胶体粒子的数目是NA | |
| C. | 4.5gSiO2晶体中含有的硅氧键数目为0.3NA | |
| D. | 氧气和臭氧的混合物1.6 g中含有0.1NA氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol苯中含有的碳碳双键数目为0.3 NA | |
| B. | 3.2g臭氧中含有的氧原子数为0.2NA | |
| C. | 1L0.1 mol•L-1 CH3COOH溶液中含有的氢原子数为0.4NA | |
| D. | 标准状况下,22.4 L盐酸中含有的HCl分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
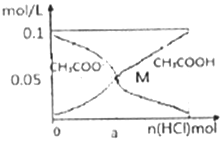 常温下向l0mL0.1mol•L-1CH3COONa溶液中,不断通入HCl气体后,CH3COO-与CH3COOH浓度的变化趋势如图所示(不考虑溶液休积变化),下列说法不正确的是( )
常温下向l0mL0.1mol•L-1CH3COONa溶液中,不断通入HCl气体后,CH3COO-与CH3COOH浓度的变化趋势如图所示(不考虑溶液休积变化),下列说法不正确的是( )| A. | 当n(HCl)=1.0×10-3mol时,溶液中 c(Na+)=c(Cl-)>c(H+)>c(CH3COO-)>c(OH-) | |
| B. | M点溶液中水的电离程度比原溶液小 | |
| C. | 随着HCl的通入,c(OH-)/c(CH3COO-) 值不断减小 | |
| D. | 在M 点时,c(H+)-c(OH-)=(a-0.05)mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com