
| A. | △H=+488.3 kJ•mol-1 | B. | △H=-244.15 kJ•mol-1 | ||
| C. | △H=-977.6 kJ•mol-1 | D. | △H=-488.3 kJ•mol-1 |
分析 利用盖斯定律计算,将(2)×2+(3)×2-(1),可得 2C(s)+2H2(g)+O2(g)═CH3COOH(l),反应热随之相加减,可求得反应热.
解答 已知:(1)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=-870.3kJ/mol
(2)C(s)+O2(g)═CO2(g)△H2=-393.5kJ/mol
(3)2H2(g)+O2(g)═2H2O(l)△H3=-285.8kJ/mol
利用盖斯定律吗,将(2)×2+(3)×2-(1)可得2C(s)+2H2(g)+O2(g)═CH3COOH(l),
则△H=2×(-393.5kJ/mol)+2×(-285.8kJ/mol)-(-870.3kJ/mol)=-488.3kJ/mol,
故选D.
点评 本题考查化学反应与能量,侧重于盖斯定律的运用,注意把握盖斯定律的原理以及计算方法,难度不大.


科目:高中化学 来源: 题型:解答题
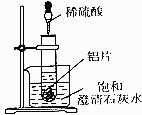 如图所示,把试管放人盛有25℃饱和澄清石灰水的烧杯中,开始往试管中加人若干铝片,再用滴管向试管中加人10mL1mol•L-1稀硫酸.
如图所示,把试管放人盛有25℃饱和澄清石灰水的烧杯中,开始往试管中加人若干铝片,再用滴管向试管中加人10mL1mol•L-1稀硫酸.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
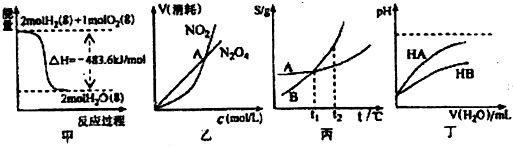
| A. | 甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6kJ•mol-l | |
| B. | 乙表示恒温恒容条件下发生的可逆反应2NO2?N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 | |
| C. | 丙表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1℃升温至t2℃时,溶质的质量分数B=A | |
| D. | 丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH大于NaB溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | HA | BOH | 溶液的体积关系 |
| ① | 强酸 | 强碱 | V(HA)<V(BOH) |
| ② | 强酸 | 强碱 | V(HA)=V(BOH) |
| ③ | 强酸 | 弱碱 | V(HA)>V(BOH) |
| ④ | 弱酸 | 强碱 | V(HA)>V(BOH) |
| A. | ①③ | B. | ②③ | C. | ②④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com