
下列各反应达到化学平衡后,加压或降温都能使化学平衡向逆反应方向移动的是()
A. 2NO2(g)⇌N2O4(g)△H<0 B. C(s)+CO2⇌2CO△H>0
C. N2+3H2⇌2NH3△H<0 D. H2S(g)⇌H2+S(s)△H>0
考点: 化学平衡的影响因素.
专题: 化学平衡专题.
分析: 根据化学平衡移动原理:增大压强,化学平衡向着气体体积减小的方向进行;升高温度,化学平衡向着吸热方向进行,据此结合选项解答.
解答: 解:A、正反应是体积减小的反应,增大压强平衡向正反应移动,正反应为放热反应,降低温度平衡向正反应移动,故A不选;
B、正反应为体积增大的反应,增大压强,平衡向逆反应移动,正反应是吸热反应,降低温度平衡向逆反应移动,故B选;
C、正反应为体积减小的反应,增大压强,平衡向正反应移动,正反应是放热反应,降低温度平衡向正反应移动,故C不选;
D、反应前后体积不变,增大压强平衡不移动,正反应是吸热反应,降低温度平衡向逆反应移动,故D不选;
故选B.
点评: 本题考查温度和压强对化学平衡移动的影响,注意根据反应特征利用平衡移动原理解答,难度不大.


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:高中化学 来源: 题型:
图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5mol/L,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是()
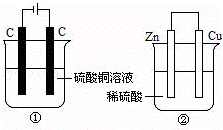
A. 产生气体体积:①=②
B. ①中阴极质量增加,②中正极质量减小
C. 电极反应式:①中阳极:4OH﹣﹣4e﹣=2H2O+O2↑②中负极:2H++2e﹣=H2↑
D. 溶液的pH变化:①减小,②增大
查看答案和解析>>
科目:高中化学 来源: 题型:
0.3mol气态高能燃料乙硼烷B2H6在O2中燃烧,生成固态B2O3和液态H2O,放出649.5kJ的热量.下列热化学方程式正确的是()
A. B2H6(g)+302(g)═B2O3(s)+3H2O(l)△H=2165 kJ•mol﹣1
B. B2H6(g)+3O2(g)═B2O3(s)+3H2O(l)△H=﹣2165 kJ•mol﹣1
C. B2H6+3O2═B2O3+3H2O△H=﹣2165 kJ•mol﹣1
D. B2H6(g)+3O2(g)═B2O3(s)+3H2O(g)△H=﹣2165 kJ•mol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
把0.6molX气体和0.4molY气体混合于容积为2L的容器中,使其发生如下反应:3X(g)+Y(g)⇌nZ(g)+2W(g).5min末生成0.2molW,若测知以Z浓度变化表示的平均反应速率为0.01mol/L•min,则n的值为()
A. 4 B. 3 C. 2 D. 1
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)一定量的A、B在2L的密闭容器中进行反应A(g)+B(g)⇌2C(g),2min后,测得各物质的浓度分别为c(A)=0.5mol/L,c(B)=0.75mol/L,c(C)=0.5mol/L,则A和B起始的物质的量分别为A: :
(2)将等物质的量的A和B,混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)═xC(g)+2D(g),经过5min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的反应速率是0.1mol/(L•min),A在5min末的浓度是 平均反应速率是 x的值为
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下用NH3捕获CO2可以生成重要的有机化工产品﹣﹣三聚氰酸,反应的化学方程式如下:NH3+CO2→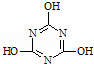 +H2O下列有关三聚氰酸的说法正确的是()
+H2O下列有关三聚氰酸的说法正确的是()
A. 分子式为C3H6N3O3
B. 分子中既含极性键,又含非极性键
C. 属于共价化合物
D. 生成该物质的上述反应为中和反应
查看答案和解析>>
科目:高中化学 来源: 题型:
将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3,且 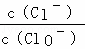 的值与温度高低有关.当n(KOH)=a mol时,下列有关说法正确的是()
的值与温度高低有关.当n(KOH)=a mol时,下列有关说法正确的是()
A. 若某温度下,反应后 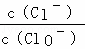 =11,则溶液中
=11,则溶液中 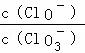 =
=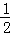
B. 参加反应的被还原的氯气为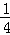 amol
amol
C. 改变温度,反应中转移电子的物质的量ne的范围: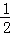 amol≤ne≤
amol≤ne≤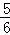 amol
amol
D. 改变温度,产物中KClO3的最大理论产量为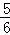 amol
amol
查看答案和解析>>
科目:高中化学 来源: 题型:
在体积相同的两个密闭的容器中分别充满O2、O3气体,当这两个容器内温度和气体密度相等时,下列说法正确的是( )
-A.-两种气体的压强相等
-B.-O2比O3的质量小
-C.-两种气体所含的质子数目相等
-D.-两种气体的分子数目相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com