
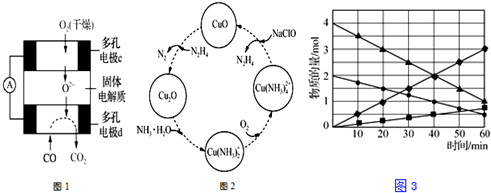
分析 (1)①该燃料电池中,负极上CO失电子发生氧化反应,正极上氧气得电子发生还原反应;
②该燃料电池中,负极上CO失电子和氧离子反应生成二氧化碳,正极上氧气得电子生成氧离子;
(2)①该反应中H、Na元素都是在化合物,化合价不变;
②Cu(NH3)2+ 和氧气反应过程中,Cu元素化合价由+1价变为+2价,O元素化合价由0价变为-2价,氧气得电子和水反应生成氢氧根离子;根据转移电子守恒计算消耗氧气的量;
③温度高时氢氧化铜分解,且气体溶解度随温度升高而降低;
(3)根据图象知,反应物的物质的量变化量一个为(4-1)mol=3mol、一个为(2-0.5)mol=1.5mol,生成物的物质的量变化量一个为(3-0)mol=3mol、一个为(0.75-0)mol=0.75mol,则反应物、生成物的物质的量变化量之比等于其计量数之比=3mol:1.5mol:3mol:0.75mol=4:2:4:1,根据C原子守恒知,计量数是4的为CO、CO2,二氧化硫的计量数是2,硫单质的计量数是1,则生成的硫单质为S2,根据反应物、生成物书写方程式.
解答 解:(1)①该燃料电池中,负极上CO失电子发生氧化反应生成二氧化碳,正极上氧气得电子发生还原反应生成氢氧根离子,二氧化碳和氢氧根离子反应生成碳酸根离子和水,所以电池反应式为2CO+O2+4OH-=2CO32-+2H2O,故答案为:2CO+O2+4OH-=2CO32-+2H2O;
②d电极上CO生成二氧化碳,则该电极上失电子发生氧化反应,电极反应式为CO+O2--2e-=CO2,
故答案为:CO+O2--2e-=CO2;
(2)①根据图知,H、Na元素都在化合物中,化合价不变,故答案为:氢、钠;
②Cu(NH3)2+ 和氧气反应过程中,Cu元素化合价由+1价变为+2价,O元素化合价由0价变为-2价,氧气得电子和水反应生成氢氧根离子,所以溶液的pH增大;
转化中当有1mol N2H4参与反应时,转移电子物质的量=1mol×2×[0-(-2)]=4mol,根据转移电子相等得需要消耗O2的物质的量=$\frac{4mol}{4}$=1mol,
故答案为:增大;1mol;
③温度高时氢氧化铜分解,且气体溶解度随温度升高而降低,从而促进反应向正反应方向进行,
故答案为:使氢氧化铜分解、降低联氨溶解度使其从溶液中逸出;
(3)根据图象知,反应物的物质的量变化量一个为(4-1)mol=3mol、一个为(2-0.5)mol=1.5mol,生成物的物质的量变化量一个为(3-0)mol=3mol、一个为(0.75-0)mol=0.75mol,则反应物、生成物的物质的量变化量之比等于其计量数之比=3mol:1.5mol:3mol:0.75mol=4:2:4:1,根据C原子守恒知,计量数是4的为CO、CO2,二氧化硫的计量数是2,硫单质的计量数是1,则生成的硫单质为S2,所以反应方程式为4CO+2SO2=4CO2+S2,
故答案为:4CO+2SO2=4CO2+S2.
点评 本题考查原电池原理、氧化还原反应、化学方程式计算等知识点,为高频考点,结合电解质溶液书写电极反应式,难点是(3)题生成物硫化学式的确定,明确计量数与物质的量变化量关系是解(3)题关键,题目难度中等.


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①②③ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲-②,乙-④ | B. | 乙-③,丙-③ | C. | 乙-④,丁-② | D. | 丙-①,丁-② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳溶于水能部分电离,故二氧化碳属于电解质 | |
| B. | 硫酸钡难溶于水,但硫酸钡属于强电解质 | |
| C. | 氯化钠溶液在电流作用下完全电离成钠离子和氯离子 | |
| D. | 强电解质溶液的导电性一定比弱电解质溶液的导电性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称量时,将NaOH固体放在右盘,砝码放在左盘 | |
| B. | 将NaOH固体在烧杯中溶解,所得的溶液冷却至室温后,再转移到容量瓶中 | |
| C. | 转移液体时,可以不用将洗涤液转至容量瓶 | |
| D. | 定容时,可以俯视刻度线读数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com