
【题目】2020年5月5日晚18时00分,我国载人空间站货物返回舱试验舱在我国文昌航天发射场点火升空, 5月8日飞船试验船返回舱在东风着陆场预定区域成功着陆,试验取得圆满成功。金属铍(Be)是火箭、航空、宇宙航行的重要材料,工业上以含铍废渣(主要成分是Be和MgF2)为原料制备金属铍的工艺流程如图:
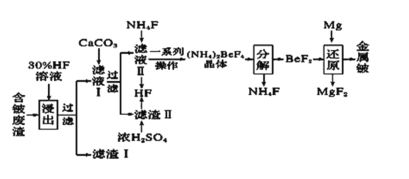
已知:MgF2和CaF2难溶于水。回答下列问题:
(1)提高浸出速率的方法有________、_______(任写两项);已知滤液Ⅰ中铍元素的存在形式为H2BeF4,写出“浸出”过程中发生反应的化学方程式:____________。
(2)过滤所得滤渣I的主要成分为________(填化学式)。
(3)该流程中可循环利用的物质是____________________;滤渣Ⅱ与浓硫酸发生反应的化学方程式为__________________________________________________;已知(NH4)2BeF4易溶于水,且其在水中的溶解度随温度的升高而大幅度增大,从NH4F与滤液Ⅱ发生反应后所得溶液中获得(NH4)2BeF4晶体的“一系列操作”具体是指____________________ 过滤、洗涤、干燥。
(4) “分解”过程中产生的BeF2在熔融状态下不能导电,其电子式为_____________;“还原”过程可以用金属镁制备金属铍的原因是__________________________。
【答案】粉碎废渣、增大HF溶液的浓度 适当升高温度、充分搅拌(写两项即可) Be+4HF=H2BeF4+H2↑ MgF2 HF、NH4F CaF2+H2SO4 (浓) ![]() CaSO4+2HF↑ 蒸发浓缩、冷却结晶
CaSO4+2HF↑ 蒸发浓缩、冷却结晶 ![]() 镁的还原性比铍强
镁的还原性比铍强
【解析】
将含铍废渣(主要成分是Be和MgF2)用30%HF溶液酸浸,MgF2难溶于水,所以得到的滤渣I为MgF2,根据题目信息可知滤液I中主要含有H2BeF4,过滤分离,向滤液Ⅰ中加入CaCO3,除去溶液中过量的HF,过滤得到滤渣II为 CaF2和含有H2BeF4的滤液Ⅱ,向滤液Ⅱ中加入NH4F得到(NH4)2BeF4,同时得到HF,浓硫酸和滤渣II反应也可以生成HF,得到的HF可以循环使用;经过后续一系列操作得到较纯的(NH4)2BeF4晶体,将晶体分解得到NH4F和BeF2,用Mg还原BeF2得到较纯的金属Be,NH4F则可以循环使用。
(1)粉碎废渣、增大HF溶液的浓度、适当升高温度、充分搅拌都可以提高浸出速率;反应有Be和HF,产物有H2BeF4,该过程Be元素被氧化,根据元素的价态规律可知应是H元素将Be元素氧化,所以化学方程式为Be+4HF=H2BeF4+H2↑;
(2)滤渣I主要为难溶于水的MgF2;
(3)根据分析可知循环使用的有HF和NH4F;滤渣II主要CaF2,与浓硫酸发生复分解反应生成HF,方程式为CaF2+H2SO4 (浓) ![]() CaSO4+2HF↑;(NH4)2BeF4易溶于水,且其在水中的溶解度随温度的升高而大幅度增大,所以可以先加热混合溶液蒸发浓缩,再冷却析出(NH4)2BeF4晶体,所以一系列操作为蒸发浓缩、冷却结晶、过滤、洗涤、干燥;
CaSO4+2HF↑;(NH4)2BeF4易溶于水,且其在水中的溶解度随温度的升高而大幅度增大,所以可以先加热混合溶液蒸发浓缩,再冷却析出(NH4)2BeF4晶体,所以一系列操作为蒸发浓缩、冷却结晶、过滤、洗涤、干燥;
(4)BeF2在熔融状态下不能导电,说明其为共价化合物,所以电子式为![]() ;铍和镁位于同一主族,且镁位于铍的下方,所以镁的金属性比铍强,则镁的还原性比铍强,可以用金属镁制备金属铍。
;铍和镁位于同一主族,且镁位于铍的下方,所以镁的金属性比铍强,则镁的还原性比铍强,可以用金属镁制备金属铍。


科目:高中化学 来源: 题型:
【题目】有氯化钠和碘化钠的混合物共26.7 g,溶于水,通入足量氯气后,蒸干、灼烧,固体质量变为 17.55 g。
(1)原混合物中碘化钠的质量是________。
(2)原混合物中氯化钠的质量分数是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在浓盐酸中H3AsO3与SnCl2反应的离子方程式为3Sn2++2H3AsO3+6H++18Cl-![]() 2As+3
2As+3![]() +6M关于该反应的说法中正确的组合是
+6M关于该反应的说法中正确的组合是
①氧化剂是H3AsO3
②还原性:As>SnCl2
③每生成1molAs,反应中转移电子的物质的量为3mol
④M为OH-
⑤![]() 是氧化产物
是氧化产物
A.①②④⑤B.①③⑤C.①②③④D.只有①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是与绿色化学、环境保护和人类健康息息相关的三个主题,请根据已知信息回答下列问题:
(1)下列制备氯乙烷的反应中原子经济性最高的是_____(填字母)。
A.CH2=CH2+HCl→CH3CH2Cl
B.CH3CH2OH+HCl![]() CH3CH2Cl+H2O
CH3CH2Cl+H2O
C.CH3CH3+Cl2![]() CH3CH2Cl+HCl
CH3CH2Cl+HCl
D.CH2=CHCl+H2![]() CH3CH2Cl
CH3CH2Cl
由上述四个反应可归纳出,原子经济性最高的是______(填反应类型)。
(2)有毒物质的无害化处理也是绿色化学研究的内容之一。ClO2是一种性能优良的消毒剂,它可将废水中少量的CN-等有毒的酸根离子氧化而除去。请写出用ClO2将废水中的CN-氧化成无毒气体的离子方程式:______,该方法的优点是_______。
(3)某饮用水厂由天然水制备纯净水(去离子水)的工艺流程示意图如图:
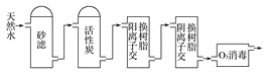
活性炭的作用是_______;O3消毒的优点是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,全国部分地区被雾霾笼罩,机动车尾气排放成为引发雾霾的罪魁祸首。提高空气质量,减少机动车尾气排放成为当务之急。汽车内燃机工作时引起反应:N2(g)+O2(g) ![]() 2NO(g),是导致汽车尾气中含有NO的原因之一。已知断裂某些共价键需要的能量如表:
2NO(g),是导致汽车尾气中含有NO的原因之一。已知断裂某些共价键需要的能量如表:
断裂的共价键 | O =O | N≡N | N—O |
需要的能量 | 495 kJ·mol-1 | 945 kJ·mol-1 | 630 kJ·mol-1 |
(1)机动车发动机工作时会引发N2和O2的反应,该反应是____(填“放热”或“吸热”)反应,1 molO2与1 molN2的总能量比2 molNO的总能量___(填“大”或“小”)。
(2)N2与O2合成NO的热化学方程式可以表示为![]() N2(g)+
N2(g)+![]() O2(g)=NO(g)ΔH,则ΔH=_____。
O2(g)=NO(g)ΔH,则ΔH=_____。
(3)NO与CO反应的热化学方程式可以表示为2NO(g)+2CO(g)=2CO2(g)+N2(g) ΔH=a kJ·mol-1,但该反应的速率很小,若使用机动车尾气催化转化器,尾气中的NO与CO可以转化成无害物质排出。上述反应在使用“催化转化器”后,a___(填“增大”“减小”或“不变”)。
(4)已知:①Fe(s)+![]() O2(g)=FeO(s) ΔH1=-275.0 kJ·mol-1;
O2(g)=FeO(s) ΔH1=-275.0 kJ·mol-1;
②2Al(s)+![]() O2(g)=Al2O3(s) ΔH2=-1 675.0 kJ·mol-1。
O2(g)=Al2O3(s) ΔH2=-1 675.0 kJ·mol-1。
Al和FeO发生铝热反应的热化学方程式是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用胆矾制取氧化铜,并研究氧化铜能否在氯酸钾受热分解实验中起催化作用,实验步骤如下:①称量ag胆矾固体放入烧杯中,加水制成溶液,向其中滴加氢氧化钠溶液至沉淀完全;②过滤步骤①中的混合物,洗涤固体;③将②中的固体转移至蒸发皿中,加热至固体全部变成黑色氧化铜为止,称量所得固体质量为bg;④取一定质量的上述氧化铜固体和一定质量的氯酸钾固体,混合均匀后加热,收集反应生成的氧气(装置如图所示)。请回答下列问题:
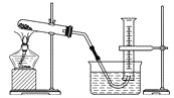
(1)上述各步操作中,需要用到玻璃棒的是________(填写前面所述实验步骤的序号)。
(2)由胆矾制得的氧化铜的产率(实际产量与理论产量的百分比)为________×100%。
(3)为证明氧化铜在氯酸钾的分解反应中起催化作用,在上述实验①~④后还应该进行的实验操作是__________(按实验先后顺序填写字母序号)。
a.过滤 b.烘干 c.溶解 d.洗涤 e.称量
(4)但有很大一部分同学认为,还必须另外再设计一个实验才能证明氧化铜在氯酸钾受热分解的实验中起催化作用。你认为还应该进行的另一个实验是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应2AB=A2+B2的能量变化如图所示,下列说法正确的是( )
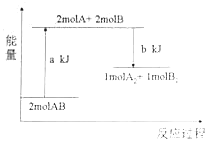
A.该反应是放热反应
B.该反应一定要在加热条件下才能进行
C.断开1molA2中的化学键和1mol B2中的化学键需吸收akJ的能量
D.1mol A2和1molB2的总能量高于2mol AB的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用质量分数为36.5%的浓盐酸(密度为1.25 g·mL-1),配制240 mL 0.1mol·L-1的盐酸,请回答下列问题:
(1)浓盐酸的物质的量浓度为__________。
(2)配制240 mL 0.1 mol·L-1的盐酸,应量取浓盐酸体积__________mL。
(3)应选用容量瓶的规格__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】V2O5(五氧化二钒)可作化学工业中的催化剂,广泛用于冶金、化工等行业。工业上利用冶炼铝生成的固体废料一一赤泥(主要成分为Fe2O3、Al2O3、V2O5及少量稀土金属氧化物)提取V2O5其工艺流程图如图:
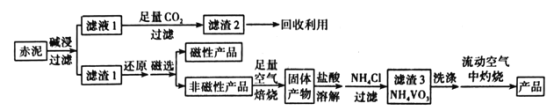
已知:①NH4VO3是白色粉末,微溶于冷水,可溶于热水。
②NH4VO3![]() V2O5+2NH3↑+H2O
V2O5+2NH3↑+H2O
③V2O5是一种橙黄色片状晶体,微溶于水,不溶于乙醇,具有强氧化性。
④部分稀土金属氯化物在乙醇中溶解度较小。
(1)“碱浸”时对赤泥进行粉碎的目的是___。写出滤液1中通入足量CO2时所发生主要反应的离子方程式:___。
(2)将磁性产品加入稀硝酸溶解,取上层清液再加入KSCN溶液后未见红色,写出该磁性产品与稀硝酸反应的离子方程式:___。
(3)“洗涤”操作时可选用的洗涤剂有___。(填字母)
A.冷水 B.热水C.1%NH4Cl溶液 D.乙醇
(4)需在流动空气中灼烧的原因可能是___。
(5)将0.253g产品溶于强碱溶液中,加热煮沸,调节pH为8~8.5,向反应后的溶液中加入硫酸酸化的KI溶液(过量),溶液中的还原产物为V3+离子,滴加指示剂,用0.250molL-1Na2S2O3溶液滴定,达到终点时消耗Na2S2O3标准溶液20.00mL,则该产品的纯度为___。
(已知:I2+2Na2S2O3=Na2S4O6+2NaI,结果保留三位有效数字)
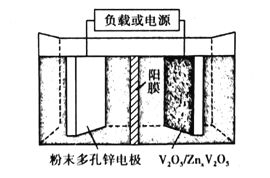
(6)水系锌离子电池是一种新型二次电池,以Zn(CF3SO3)2(三氟甲磺酸锌)为电解质,工作原理如图。放电时V2O5电极上的电极反应式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com