

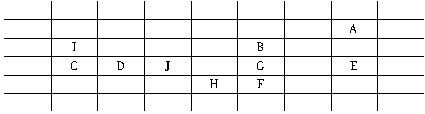
该试题摆脱了传统的命题模式,呈现在同学们面前的是全新的情境,这种创意很好。从试题的考查目的来看,对于那些死记硬背的同学来说,简直是一筹莫展,只有那些真正理解了元素周期律实质的同学才能顺利完成本题,试题本身具有很好的区分度。在回答问题时,我们首先要考虑的是把这10种元素的“相对原子质量”按从小到大的顺序排列起来:A(1.0)→I(3.9)→B(8.0)→C(15.6)→D(17.1)→J(18.0)→G(20.0)→E(23.8)→H(29.6)→F(31.8)。因为在表中已经把A、B、H三种元素的位置填写好了,而A、E的化学性质相似(都不发生化学反应),说明E必在A的正下方,且E不能排在H的后面(因为E的“相对原子质量”小于H),可以把E的位置确定下来。B、F、H的化学性质相似(可能是同一周期的左右关系,也可能是同一族的上下关系),根据“相对原子质量”大小关系可以肯定F在B的正下方且在H的后面,这样,F的位置就可以确定下来了。余下的I、C、D、J、G五种元素,因为I和C的化学性质相似,且“相对原子质量”相差较大,则I和C应在同一族内且上下相邻,C在I的正下方。C、D、J三种元素的“相对原子质量”都很接近且依次增大,可以判断C、D、J是同一周期依次相邻的三种元素。G的性质与B、F、H相似,那么G是在H的正上方还是在B与F之间呢?可以这样分析:若G在H的正上方,则上下相邻的G、H二者的“相对原子质量”的差值为29.6-20.0=9.6,这个差值比I、C二者的“相对原子质量”的差值15.6-3.9=11.7还小,这是不行的,所以G应在B与F之间(此时G、F的“相对原子质量”的差值为31.8-20.0=11.8,它大于11.7,合理。其原因请同学们结合元素周期律自己思考)。综上所述,所得结论如下表所示:


 轻松暑假总复习系列答案
轻松暑假总复习系列答案湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com